| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学反应速率》试题预测(2019年最新版)(二)
(3)t2℃时,若将物质的量之比n(SO2)∶n(O2)=1∶1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。 参考答案:(1)0.1 mol·L-1·min-1 20% 本题解析:(1) 2SO2(g)+O2(g) 本题难度:简单 2、填空题 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: |
 E.混合气体的总物质的量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变化参考答案:(5分)(1)3X+Y 2Z;(2)0.05mol/(L·min);(3)0.35mol/L;
2Z;(2)0.05mol/(L·min);(3)0.35mol/L;
(4)化学平衡;(5)BEFH
本题解析:(1)根据图像可知,反应进行到2min时物质的浓度不再发生变化,说明反应达到平衡状态。此时消耗X和Y的物质的量分别是0.3mol、0.1mol,生成Z的物质的量是0.2mol,所以根据变化量之比是相应的化学计量数之比可知,该反应的化学方程式是3X+Y 2Z。
2Z。
(2)从开始至2min,Z的平均反应速率为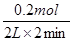 =0.05mol/(L·min)。
=0.05mol/(L·min)。
(3)3min时,混合物中X的物质的量浓度为0.7mol÷2L=0.35mol/L。
(4)2分钟后X、Y、Z各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了平衡状态。
(5)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,A不能说明。该反应是体积减小的可逆反应,所以当压强或物质的量不再发生变化时可以说明,BE正确。C中反应速率的方向相同,速率之比是相应的化学计量数之比,因此C中的关系始终是成立,不正确。根据质量守恒定律可知,D中的关系始终是成立的,不能说明。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以F可以说明。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,G不正确,H中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,因此答案选BEFH。
点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养,有利于培养学生的逻辑推理能力和规范的答题能力。该题的难点是平衡状态的判断。
本题难度:一般
3、选择题 在一条件下,反应N2 + 3H2 2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
A.1.2mol·L
参考答案:
本题解析:
本题难度:简单
4、选择题 10mL浓度为1mol?L-1的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的3mol?L-1的硫酸
B.加入适量蒸馏水
C.加入数滴硫酸铜溶液
D.加入适量的硫酸钠溶液
参考答案:A.加入适量的3mol.L-1的硫酸,增大氢离子的浓度,也增大了氢离子的物质的量,故A错误;
B.加入适量蒸馏水,氢离子的浓度减小,不改变氢离子的物质的量,化学反应速率减小,故B错误;
C.加入数滴硫酸铜溶液,Zn足量,构成Cu、Zn原电池,加快反应速率,且没有改变氢离子的物质的量,不影响生成的氢气的总量,故C正确;
D.加入适量的硫酸钠溶液,氢离子的浓度减小,不改变氢离子的物质的量,化学反应速率减小,故D错误;
故选C.
本题解析:
本题难度:一般
5、计算题 在 2 L的密闭容器中, 充入 1 mol N2和 3 mol H2, 在一定的条件下反应, 2 分钟后达到平衡状态, 相同温度下, 测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10, 计算:(1) 平衡时混合气体中三种气体的物质的量比为多少?
(2) N2的转化率为多少?
(3) 2分钟内, NH3的平均反应速率为多少?
参考答案:(1)2:6:1(2)20% (3)0.1 mol/L·min
本题解析:略
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《分子式、结构式、.. | |