1、填空题 钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
______________________________。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3·xH2O),反应的化学方程式是:?
______________________________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是:____________________________。
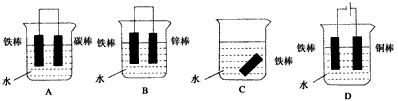
(4)下列哪个装置可防止铁棒被腐蚀____________。
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下

请回答
①A电极对应的金属是____________(写元素名称),B电极的电极反应式是:____________。
②若电镀前铁、铜两极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为____________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因__________________________。
参考答案:(1)3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(2)4Fe+3O2+2xH2O==2Fe2O3·xH2O
(3)2FeCl3+Fe==3FeCl2
(4)BD
(5)①铜;Cu2++2e-==Cu;②0.08;③铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀
本题解析:
本题难度:一般
2、选择题 下列关于金属腐蚀叙述正确的是?
[? ]
A.金属在潮湿空气中腐蚀的实质是:M+nH2O===M(OH)n+n/2H2↑
B.金属的化学腐蚀的实质是M-ne-===Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀
参考答案:B
本题解析:
本题难度:简单
3、简答题 如图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物.
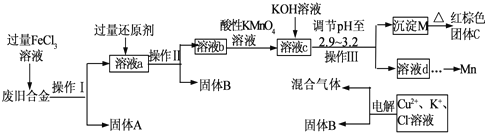
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是______.
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:______.
(3)过量的还原剂应是______.
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为______.
②若用Xmol/LKMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液Y mL,则最后所得红棕色固体C的质量为______g(用含X、Y的 代数式表示).
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:______.(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Zg,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为______L(用含Z的代数式表示);该电极的反应式为______.
参考答案:(1)通过操作Ⅰ、Ⅱ、Ⅲ都得到固体和溶液,所用该操作是过滤,过滤是把不溶性固体和溶液分开的操作,
故答案为:过滤;
(2)FeCl3具有氧化性,会把铁、铜氧化,反应方程式为:2FeCl3+Fe=3FeCl2、2FeCl3+Cu=2FeCl2+CuCl2,
故答案为:FeCl3+Fe=3FeCl2、2FeCl3+Cu=2FeCl2+CuCl2;
(3)根据流程最后滤液中含铜,加入过量的还原剂目的是还原过量的氯化铁,故应加铜,故答案为:铜粉;
(4)①溶液b中含亚铁离子,会被酸性高锰酸钾氧化成铁离子,高锰酸钾被还原为锰离子,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②根据关系式计算:
2 MnO4-~10Fe2+~5Fe2O3
2105×160g
0.001XYm
m=0.001XY×5×160g2=0.4XY,
故答案为:0.4XY;
(5)因Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
溶度积常数越小,对应离子越易沉淀,故沉淀顺序为:Fe3+>Cu2+>Mn2+,
故答案为:Fe3+>Cu2+>Mn2+;
(6)由流程可知,电解氯化铜得到铜和氯气,生成Zg 铜转移电子数为:Zg64g/mol×2=Z32mol,生成氯气:Z64mol,要使两极得到气体体积相同,则还要电解水,设电解水的物质的量为x,根据反应式:2H2O通电.H2↑+O2↑可知,生成xmol氢气和0.5xmol氧气,根据两极气体体积相等可列出方程:Z64mol+0.5xmol=xmol,解得x=Z32,故生成氧气的物质的量为:Z64mol,标况下体积为:Z64mol×22.4L/mol=22.4Z64L,生成氧气的电极反应式为:4OH--4e-=O2↑+4H2O,
故答案为:22.4Z64;4OH--4e-=O2↑+4H2O.
本题解析:
本题难度:一般
4、填空题 钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:_________________________ 。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式__________________________ 。
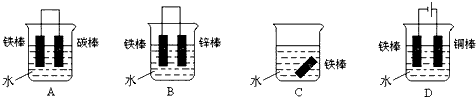
(3)下列哪个装置可防止铁棒被腐蚀_____________ 。
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下

请回答
A电极对应的金属是_________(写元素名称), B电极的电极反应式是______________________。
镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:____________________________。
参考答案:(1) 3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(2)2FeCl3+Fe==3FeCl2
(3)BD
(4)铜;Cu2++2e-==Cu;铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀(答案合理即可)
本题解析:
本题难度:一般
5、选择题 0.3 mol Cu与足量的稀HNO3完全反应时,被还原的HNO3的物质的量是
A.0.3 mol
B.0.6 mol
C.0.4 mol
D.0.2 mol
参考答案:D
本题解析:根据化学方程式3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO↑可知,反应中被还原的硝酸是参加反应的硝酸的1/4,所以如果0.3 mol Cu与足量的稀HNO3完全反应时,被还原的HNO3的物质的量是0.2mol,答案选D。
点评:该题是中等难度的试题,试题注重基础,侧重学生计算能力,特别是巧解技巧的培养和训练,有助于培养学生的逻辑推理能力和应试能力,提高学生的学习效率。该题还需要注意的是审题,即是计算参加反应的硝酸,还是被还原的或未被还原的硝酸。
本题难度:简单