1、填空题 如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)  xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
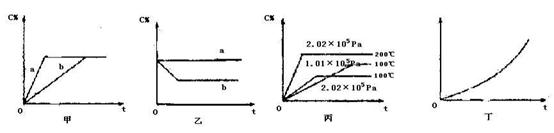
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况,速率:a b(填:大于、小于或等于)
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则 曲线表示恒温恒容的情况,此时该恒温恒容中C% (填:变大、变小或不变)
(3)根据丙图可以判断该可逆反应的正反应是 反应(填:放热、吸热),计量数x的值是 ;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是 ,[填:①C% ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)];升温平衡移动的方向为 。(填:左移或右移)
2、选择题 下列事实中,不能用勒夏特列原理解释的是( )
A.密闭、低温是存放氨水的必要条件
B.实验室常用排饱和食盐水法收集氯气
C.硝酸工业生产中,使用过量空气以提高NH3的利用率
D.合成氨反应采用较高温度和使用催化剂,以提高氨气的产量
3、选择题 相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g) 2SO3(g);
2SO3(g);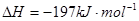 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:
容器
| 起始各物质的物质的量/mol
| 达到平衡时体系能量的变化
|
SO2
| O2
| SO3
| Ar
|
甲
| 2
| 1
| 0
| 0
| 放出热量:Q1
|
乙
| 1.8
| 0.9
| 0.2
| 0
| 放出热量:Q2
|
丙
| 1.8
| 0.9
| 0.2
| 0.1
| 放出热量:Q3
|
下列叙述正确的是 ( )
A.Q1=Q2=Q3="197" kJ
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大
4、选择题 将1?mol?H2(g)和2?mol?I2(g)置于某2?L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?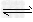 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间变化的曲线如曲线Ⅱ所示.若改变反应条件,φ(HI)的变化曲线如曲线Ⅰ所示,则改变的条件可能是
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间变化的曲线如曲线Ⅱ所示.若改变反应条件,φ(HI)的变化曲线如曲线Ⅰ所示,则改变的条件可能是
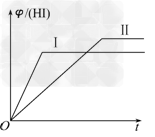
[? ]
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
5、计算题 (10分)现有可逆反应:2A(g)+3B(g) nC(g)+4D(g),起始时,将amol的A与bmol的B充入固定容积的密闭容器中,在一定条件下达平衡,测得A、B的转化率相等。
nC(g)+4D(g),起始时,将amol的A与bmol的B充入固定容积的密闭容器中,在一定条件下达平衡,测得A、B的转化率相等。
(1)则a:b= 。
(2)若起始时在2L的密闭容器中充入4mol的A与12mol的B,在一定条件下发生上述可逆反应,经5min后达平衡,测得物质A的转化率为: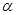 (A)=50%,测得平衡混合气体总物质的量为17mol。
(A)=50%,测得平衡混合气体总物质的量为17mol。
①则上述可逆反应中,n= 。
②B的转化率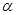 (B)= 。
(B)= 。
③在5min内,用物质D表示的平均反应速率是 。