1、填空题 (12分)在常温下,下列五种溶液:
①0.1mol/L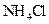 ? ②0.1mol/L
? ②0.1mol/L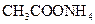 ? ③0.1mol/L
? ③0.1mol/L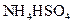
④0.1mol/L 和0.1mol/L
和0.1mol/L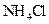 混合液? ⑤0.1mol/L
混合液? ⑤0.1mol/L
请根据要求填写下列空白:
(1)溶液①呈?性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中,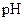 最小的是?;
最小的是?;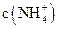 最小的是?(填序号)
最小的是?(填序号)
(3)比较溶液②、③中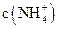 的大小关系是②?③(填“>”、“<”或“=”)
的大小关系是②?③(填“>”、“<”或“=”)
(4)在溶液④中,?离子的浓度为0.1mol/L; 和?离子的物质的量浓度之和为0.2mol/L。
和?离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的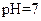 ,则说明
,则说明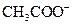 的水解程度?(填“>”、“<”或“=”)
的水解程度?(填“>”、“<”或“=”)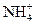 的水解程度,
的水解程度,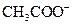 与
与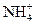 浓度的大小关系是:
浓度的大小关系是:
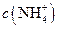 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
2、选择题 下列表述中正确的是? (? )
A.NH4C1溶液因水解而显酸性,故NH4C1是弱电解质
B.纯碱溶液因水解而显碱性,水解的离子方程式为:CO32—+H2O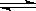 H2CO3+2OH—
H2CO3+2OH—
C.可乐因含碳酸而显酸性,电离方程式为:H2CO3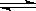 CO32—+2H+
CO32—+2H+
D.配制FeC13 溶液时,先将FeC13 溶于较浓的盐酸中,然后再加水稀释到所需浓度
3、选择题 下列有关0.1 mol/L NaHCO3溶液中粒子浓度关系式正确的是
A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
B.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3)
D.c(Na+)+ c(H+)= c(HCO3-)+2c(CO32-) + c(OH-)
4、选择题 常温下,若HA溶液和NaOH溶液混合后pH=7,下列说法不合理的是
A.反应后HA溶液可能有剩余
B.生成物NaA的水溶液的pH可能小于7
C.HA溶液和NaOH溶液的体积可能不相等
D.HA溶液的c(H+)和NaOH溶液的c(OH-)可能不相等
5、选择题 下列叙述正确的是(?)
A.NaHCO3溶液中:c(H+) + c(H2CO3) = c(CO32?) + c(OH?)
B.NaHCO3溶液与NaOH溶液混合时,反应的离子方程式为:HCO3?+ OH?= CO2↑ + H2O
C.0.2mol·L?1 HCl溶液与等体积0.05 mol·L?1 Ba(OH)2溶液混合后,溶液的pH=1
D.无色透明的酸性溶液中,Fe3+、K+、SO42?、NO3?能大量共存