1、选择题 下列说法正确的是(其中NA表示阿伏加德罗常数)
A.质子数相等、中子数不等的微粒一定属于同位素
B.比黄金还贵的18O2和普通的16O2是两种不同的核素
C.常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA
D.对人体有害元素氡的放射性同位素22286Rn,其原子中的质子数为136
参考答案:C
本题解析:A.质子数相等、中子数不等的微粒一定属于同位素,应该是原子,错误;B.核素的对象是原子,错误;C.正确;D.其原子中的质子数为86,错误;
本题难度:一般
2、选择题 下列排列顺序不正确的是
A.原子半径:钠>磷>氟>氢
B.酸性: HClO4>H2SO4>H3PO4
C.热稳定性:碘化氢>溴化氢>氟化氢
D.还原性:S2- >Cl- > F-
参考答案:C
本题解析:同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则选项A正确;非金属性越强,最高价氧化物的水化物的酸性越强,选项B正确;非金属性越强,氢化物的稳定性越强,选项C不正确,稳定性应该是氟化氢>溴化氢>碘化氢;非金属性越强,相应阴离子的还原性越弱,选项D正确,答案选C。
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力。难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:一般
3、选择题 2011年3月11日日本大地震造成日本福岛核电站出现严重事故,由核反应堆泄漏出的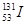 和
和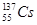 引起全世界的关注,其中
引起全世界的关注,其中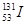 原子核内的中子数为
原子核内的中子数为
A. 53
B. 78
C. 131
D.184
参考答案:B
本题解析:具体的原子表示为A Z X,其中A为质量数,Z为质子数,N(中子数)=A—Z;所以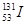 原子核内的中子数=131—53=78
原子核内的中子数=131—53=78
本题难度:简单
4、选择题 提纯含少量NaHCO3杂质的Na2CO3固体所需仪器为
①试管? ②泥三角? ③蒸发皿? ④试管夹? ⑤坩埚? ⑥玻璃棒? ⑦石棉网? ⑧坩埚钳
A.①④
B.②⑤⑧
C.③⑥
D.⑥⑦
参考答案:B
本题解析:除去碳酸钠固体中少量的碳酸氢钠,需要用给混合固体加热的方法,因为NaHCO3受热易分解.用坩埚可以给固体物质加热,用坩埚必须配有坩埚钳和泥三角,因为可直接加热,不必用石棉网.
本题难度:困难
5、选择题 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是(?)
A.四种元素的氢化物中,Y的氢化物沸点最高
B.Z的单质不溶于水,有多种同素异形体
C.阴离子的还原性:X< Y
D. X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐
参考答案:C
本题解析:考查元素周期表的结构和元素周期律的应用。Y原子的最外层电子数是次外层电子数的3倍,所以Y只能是O,则根据元素在周期表中的位置可知X是N、Z是S、W是Cl。水分子中存在氢键,沸点最高。硫有多种同素异形体,其单质不溶于水。氨气和硝酸反应生成硝酸铵。非金属性是O大于N,所以阴离子的还原性是X>Y,因此正确的答案是C。
本题难度:一般