1、选择题 醋酸溶液中存在电离平衡CH3COOH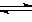 H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
[? ]
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.升高温度,醋酸溶液的pH值变小
参考答案:B
本题解析:
本题难度:一般
2、选择题 用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是? ( )。
A.c(OH-)/c(NH3·H2O)
B.c(NH3·H2O)/c(OH-)
C.n(OH-)和c(H+)
D.c(H+)和c(OH-)的乘积
参考答案:B
本题解析:加水促进NH3·H2O的电离,使n(NH3·H2O)减小,n(OH-)增大,c(OH-)减小,但c(H+)和c(OH-)的乘积即KW不变,则c(H+)增大。因此c(NH3·H2O)/c(OH-)=n(NH3·H2O)/n(OH-)减小。
本题难度:简单
3、填空题 (12分)按要求回答下列问题:
(1)常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是 (填字母)
A.溶液中导电粒子的数目将减少
B.由水电离的c(H+)浓度将减小
C.溶液中不变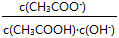
D.溶液中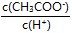 将减小
将减小
E.醋酸的电离程度将增大,c(H+)也增大
(2)①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1:V2= (忽略溶液体积的变化)。
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是 (填字母)
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有:c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c(OH-)
(3)常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示:
溶液
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
|
①写出向NaClO溶液中通入少量CO2的离子方程式 。
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是 (填字母)
A.HCN B.HClO C.H2CO3 D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)= (填准确数值)。
(4)已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于 。
参考答案:(12分)
(1)CD (2分) (2)①2:1(1分) ②AD (2分)
(3)①ClO-+CO2+H2O==HClO+HCO3- (2分) ②A (1分) ③1.98×10-6mol/L (2分)
(4)1/3×10-8mol/L或3.3×10-9mol/L (2分)
本题解析:(1)A、向醋酸溶液中加水稀释,则醋酸的电离平衡正向移动,所以醋酸根离子、氢离子的物质的量增大,导电粒子的数目增多,错误;B、电离平衡尽管正向移动,但最终氢离子的浓度减小,则对水的抑制作用减小,所以水电离氢离子浓度增大,错误;C、溶液中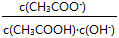 =Ka/Kw,二者都是平衡常数,温度不变,则该常数不变,正确;D、醋酸稀释后醋酸根离子浓度减小,氢离子浓度也减小,但水的电离程度增大,所以氢离子浓度减小的程度较小,所以
=Ka/Kw,二者都是平衡常数,温度不变,则该常数不变,正确;D、醋酸稀释后醋酸根离子浓度减小,氢离子浓度也减小,但水的电离程度增大,所以氢离子浓度减小的程度较小,所以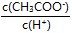 减小,正确;E、稀释时,醋酸的电离平衡正向移动,醋酸的电离度增大,但氢离子浓度减小,错误,答案选CD;
减小,正确;E、稀释时,醋酸的电离平衡正向移动,醋酸的电离度增大,但氢离子浓度减小,错误,答案选CD;
(2)①硫酸与氢氧化钠混合后的pH=1,则氢离子浓度为0.1mol/L,所以(0.1mol/L×V1mL×2-0.1mol/L×V2mL)/(V1+V2)mL=0.1mol/L,解得V1=2V2,所以V1:V2=2:1;
②A、若混合后的溶液呈中性,则c(H+)=c(OH-)=1×10-7mol/L,所以c(H+)+c(OH-)=2×10-7mol/L,正确;B、因为BOH的碱性强弱未知,所以V1=V2时,溶液可能是中性,也可能是酸性,错误;C、若V1=V2,则混合后不一定有:c(Cl-)>c(B+)>c(H+)>c(OH-),如BOH为强碱,则有若V1=V2,则混合后一定有:c(Cl-)=c(B+)>c(H+)=c(OH-),错误;D、混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c(OH-),符合电荷守恒定律,正确,答案选AD;
(3)①根据表中数据可知NaClO的碱性比碳酸钠溶液的碱性弱,则少量二氧化碳通入NaClO溶液中,只能生成碳酸氢钠和HClO,不能生成碳酸钠,则离子方程式是ClO-+CO2+H2O==HClO+HCO3-;
②将酸溶液稀释相同的倍数时,酸越弱,则加水稀释时电离度增大的程度越大,则pH增大的程度越小,四种酸中NaCN的碱性最强,说明HCN的酸性最弱,所以稀释相同倍数时pH变化最小的是HCN,答案选A;
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒,有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒,有2c(Na+)= c(CH3COO-)+c(CH3COOH),两式结合得c(CH3COO-)-c(CH3COOH)= 2c(H+)-2c(OH-)=1.98×10-6mol/L;
(4)Ksp(AgCl)=1.0×10-10= c(Cl-) c(Ag+),Ksp (CH3COOAg)=9.0×10-4= c(CH3COO-)c(Ag+),常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则CH3COOAg加入到氯化钠溶液中,形成饱和溶液时,银离子的浓度为3.0×10-2mol/L,若产生AgCl沉淀,则c(Cl-) c(Ag+)>1.0×10-10,c(Cl-)>1.0×10-10/ c(Ag+)=1/3×10-8mol/L。
考点:考查溶液中化学平衡的移动判断,溶度积常数的应用
本题难度:困难
4、选择题 pH相同的盐酸和醋酸溶液分别加水稀释n倍和m倍后,结果pH相同,则n和m的关系是
[? ]
A.n>m
B.n<m
C.n=m
D.无法确定
参考答案:B
本题解析:
本题难度:一般
5、填空题 (14分)回答下列问题:
(1)下列物质中 ①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤Ba(OH)2溶液 ⑥熔融NaCl ⑦稀氨水 ⑧BaSO4 ⑨H2O。属于强电解质的是 (填序号),属于弱电解质的是 (填序号);写出③的电离方程式
(2)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是 ;
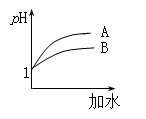
(3)一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c来回答)。当它们的pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为________;当它们的物质的量浓度相同时,pH由大到小的顺序是_____________。
(4)现有25℃、pH=13的Ba(OH)2溶液,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH= .
参考答案:(1)④⑥⑧ ③⑨ CH3COOH 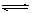 CH3COO-+H+ (2)A (3)c>a=b; c >a> b (4)2
CH3COO-+H+ (2)A (3)c>a=b; c >a> b (4)2
本题解析:
试题解析:(1)能够完全电离的为强电解质,满足条件为:④NaHCO3 ⑥熔融NaCl ⑧BaSO4 ;只能部分电离,存在电离平衡的为弱电解质,满足条件为:③CH3COOH ⑨H2O; 醋酸在水溶液中电离出醋酸根和氢离子,电离方程式为:CH3COOH 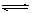 CH3COO-+H+;(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH大于HCl,根据图象知,A是HCl变化曲线,故选A;(3)当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b,
CH3COO-+H+;(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH大于HCl,根据图象知,A是HCl变化曲线,故选A;(3)当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b,
故答案为:c>a=b;硫酸为二元强酸,盐酸为一元强酸,醋酸为一元弱酸,则物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c;(2)设盐酸的物质的量浓度为:C(HCl),碱与酸体积分别为1L、9L,则n(OH -)=0.1mol/L×1L=0.1mol,n(H+)=C(HCl)×9L,反应后剩余氢氧根离子的物质的量为:0.1mol-c(HCl)×9L;有混合所得溶液pH=11,可知混合后c(H+)=10-11 mol?L-1,则混合后c(OH -)= =10-3 mol?L-1,即:
=10-3 mol?L-1,即: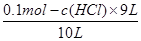 =10-3 mol?L-1,解得:c(HCl)=10-2mol?L-1,pH=-lg[H+],所以pH=2.
=10-3 mol?L-1,解得:c(HCl)=10-2mol?L-1,pH=-lg[H+],所以pH=2.
考点:弱电解质的电离;pH的简单计算
本题难度:一般