|
高考化学必考知识点《铁的氧化物》高频试题强化练习(2019年最新版)(二)
2019-06-25 21:56:00
【 大 中 小】
|
1、选择题 据报道,纳米Fe3 O4晶体材料可以作为核磁共振造影增强剂 ,用于疾病的诊断和作为药物载体用于疾病的治疗。其制备过程如图所示、下列叙述不合理的是
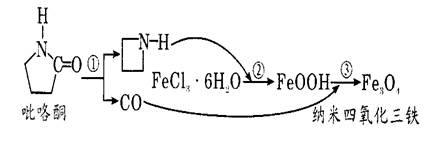
A.Fe3O4可以表示为 FeO·Fe2O3,属于混合物
B.反应③的化学方程式是:6FeOOH + CO ==2Fe3O4+3H2O+CO2
C.纳米四氧化三铁分散在适当分散剂中,形成的分散系可能有丁达尔现象
D.在反应②环丙胺的作用可能是促进氯化铁水解
参考答案:A
本题解析:略
本题难度:一般
2、实验题 (12分)某氧化铁样品中含有少量的FeCl2杂质。现要测定其中铁元素的质量分数,按以下步骤进行实验:
请根据图的流程,回答下列问题:
⑴操作I的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有?(填仪器名称);操作II必须用到的仪器是?。(填字母)
A.50ml烧杯
B.50ml量筒
C.100ml量筒
D.25ml滴定管
| 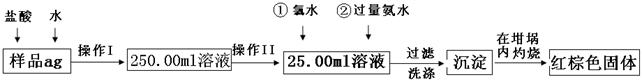
⑵再加入氨水的离子方程式为?。
⑶检验沉淀是否洗涤干净的操作是
?。
⑷将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,则接下来还应进行的操作是?。
⑸若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数是?。
⑹有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干燃烧称量即可,请你评价是否可行??。(填“可行”或“不可行”)
参考答案:⑴250ml容量瓶(1分) D(1分)⑵Fe3++3NH3H2O = Fe(OH)3↓+3NH4+(2分)
⑶取少量最后一次洗液于试管中,加入AgNO3溶液,若无白色沉淀,则沉淀洗净。(2分)
⑷继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g(2分)
⑸7(W2-W1)/a(2分)?⑹可行(2分)
本题解析:(1)根据配制原理可知,还缺少250ml容量瓶。操作II是准确量取溶液的,所以应该用滴定管,答案选D。
(2)加入氨水的目的是沉淀溶液中的铁离子,方程式是Fe3++3NH3H2O = Fe(OH)3↓+3NH4+。
(3)沉淀表面吸附着氯离子,所以可以通过检验氯离子的方法检验沉淀是否洗净,即取少量最后一次洗液于试管中,加入AgNO3溶液,若无白色沉淀,则沉淀洗净。
(4)b1—b2=0.3,说明固体还需要再次加热,即继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g为止。
(5)(W2-W1)表示生成的氧化铁的质量,所以原样品中铁元素的质量分数是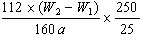 =7(W2-W1)/a。 =7(W2-W1)/a。
(6)氯化亚铁极易被氧化,氯化铁水解生成氢氧化铁,加热促进水解,同时生成的氯化氢极易水解,所以最终生成的是氢氧化铁,灼烧得到氧化铁,因此方案是可以的。
本题难度:一般
3、选择题 下列化合物中,不能由单质直接化合而得到的是
[? ]
A.Fe3O4
B.Na2O2
C.FeCl2
D.FeCl3
参考答案:C
本题解析:
本题难度:简单
4、判断题 (15分)已知A为常见的金属单质,根据下图所示的关系:
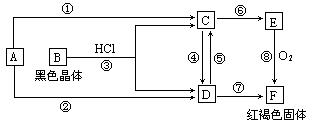
(1)确定A、B的化学式,A为 __________,B为 ___________。
(2)C和D可相互转化,描述C→D溶液的颜色变化:____________________。
④的离子方程式:_____________________________________________________。
⑤的离子方程式:_____________________________________________________。
(3)由E→F的实验现象为:___________________________________。
写出⑧的化学方程式:___________________________________________________。
参考答案:(1)Fe(2分)? Fe3O4(2分)
(2)溶液由浅绿色到黄色(或描述成深黄、黄褐、棕黄也可)(2分)
④:Fe+2Fe3+══3Fe2+(2分,其它合理也可)
⑤:2Fe2+ + Cl2══2Fe3++2Cl-(2分,其它合理也可)
(3)沉淀由白色很快变为灰绿色,最后变为红褐色(2分)
4Fe(OH)2 + O2 + 2H2O══4Fe(OH)3(3分)
本题解析:(中难)考查铁及其化合物综合应用能力,同时考查分析判断与逻辑推理能力。从最初条件看,框图很模糊,直接得不出结论,但找到“题眼”——“红褐色固体F”,就可迅速得出F是Fe(OH)3。从而得出A为Fe,“ 黑色晶体”B为Fe3O4,继而推出C为FeSO4,D为Fe2(SO4)3,E为Fe(OH)2。技能空间:化学框图题综合性强,难度大,解题时常由于知识的综合性不够,找不到“突破口”而无法下手。在学习时要注重培养知识的全面性、系统性。本题涉及的各个反应都是应该掌握的,现归纳如下:
反应①:Fe+ 2HCl══FeCl2+H2↑
反应②:2Fe+3Cl2══2FeCl3
反应③:Fe3O4+8HCl══FeCl2+2FeCl3+4H2O
反应④:2FeCl2+ Cl2══2FeCl3
反应⑤:Fe+2FeCl3══3FeCl2
反应⑥:FeCl2 + 2NaOH══Fe(OH)2+ 2NaCl
反应⑦:FeCl3 + 3NaOH══ Fe(OH)3
反应⑧:4Fe(OH)2 + O2 + 2H2O══4Fe(OH)3
应试策略:铁及其化合物相互转化问题是化学框图题中常考内容,在金属中铁是最重要的内容,熟练掌握铁及其化合物相互转化关系以及氧化还原、盐类水解等相关知识是解答此类题目的关键。铁元素及其化合物的推断题的解题一般思路:一是寻找特征反应及特征现象,二是正确运用“铁三角”的转化关系,三是注意与其它金属及其化合物知识的综合。
本题难度:一般
5、选择题 a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种。已知:①a、c均能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为?
A.Fe Cu Al Ag Mg
B.Al Cu Mg Ag Fe
C.Mg Cu Al Ag Fe
D.Mg Ag Al Cu Fe
参考答案:C
本题解析:由(1)可判断出a、c是位于金属活动顺序中H前的金属,可能是Fe、Al、Mg中的两种。由(2)可判断出b的金属活动性大于d,即在金属活动性顺序中b在d前。由(3)可确定C为Al。由(4)可确定c、e为Al和Fe,既然c已确定为Al,则可确定e为Fe。回过头来再由(1)可知a为Mg。现在只剩下Cu、Ag两种金属尚未与字母挂联,再由(2)可知b的活动性大于d,则可确定b为Cu,d为Ag。综合以上所述,可确定a、b、c、d、e依次为 Mg、Cu、Al、Ag、Fe。故选项C符合题意。
本题难度:一般
| 