1、实验题 某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)。

(1)MgCO3的分解产物为________。
(2)装置C的作用是_____________________________________________________,
处理尾气的方法为_______________________________________________________。
(3)将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
(已知:Fe2+与K3[Fe(CN)6]反应产生蓝色沉淀)。
步骤
| 操作
| 甲组现象
| 乙组现象
|
1
| 取黑色粉末加入稀盐酸
| 溶解,无气泡
| 溶解,有气泡
|
2
| 取步骤1中溶液,滴加K3[Fe(CN)6]溶液
| 蓝色沉淀
| 蓝色沉淀
|
3
| 取步骤1中溶液,滴加KSCN溶液
| 变红
| 无现象
|
4
| 向步骤3溶液中滴加新制氯水
| 红色褪去
| 先变红,后褪色
|
?
①乙组得到的黑色粉末是________。
②甲组步骤1中反应的离子方程式为__________________________________________。
③乙组步骤4中,溶液变红的原因为_______________________________________,
溶液褪色可能的原因及其验证方法为______________________________________
④从实验安全考虑,题图装置还可采取的改进措施是__________________________
参考答案:(1)MgO、CO2 (2)除CO2 点燃
(3)①Fe ②Fe3O4+8H+=2Fe3++Fe2++4H2O ③Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色 假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立(其他合理答案即可) ④在装置BC之间添加装置E防倒吸(其他合理答案均可)
本题解析:本题考查CO与氧化铁反应的探究实验,意在考查考生对化学实验的设计与评价能力。(1)MgCO3的分解类似于CaCO3。(2)Zn粉与CO2反应制备CO时,CO2可能过量,C中氢氧化钠溶液可将过量的CO2除去。尾气中的CO会污染空气,可用点燃的方法除去。(3)①根据表格中的信息可知,甲、乙两组实验所得黑色固体分别是Fe3O4、Fe。②Fe3O4可视为FeO·Fe2O3。FeO、Fe2O3与盐酸反应的化学方程式分别为FeO+2HCl=FeCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O,叠加得Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,改写成离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O。③乙组实验步骤3得到的溶液中含有Fe2+而无Fe3+,滴加新制氯水变红是由于Fe2+被氧化为Fe3+,溶液随后褪色,可能是由于Cl2将SCN-氧化,欲验证此结论是否正确,可向溶液中重新滴加KSCN溶液,观察是否重新出现红色。若出现红色,则假设成立,否则不成立。④B装置温度较高,若发生倒吸,则会造成玻璃管炸裂,因此可在装置BC之间增加防倒吸装置。
本题难度:一般
2、填空题 (12分)某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
⑴制备硫酸亚铁溶液,最合适的试剂组为?▲ ?(填编号);
a.过量铁屑和稀硫酸?b.过量稀硫酸和铁屑?c.过量硫酸铁溶液和铁屑
⑵实验室保存硫酸亚铁溶液的一般方法是__________▲ ___________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
烧杯编号
| ①
| ②
| ③
|
加入试剂
| 铁粉0.1g
| 铁粉0.1g,0.1mol/LH2SO43mL
| 0.1mol/LH2SO43mL
|
红色出现时间(天)
| 1天
| 4天左右
| 8天以上
|
?
⑶在烧杯②中加入2种试剂后,即可观察到的现象为?▲ ?;
⑷通过比较上述3组实验,可以得出的结论为?▲ ?;
⑸硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
①?试用一个离子方程式表示上述反应过程中的变化?▲ ?;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因?▲ ?。
参考答案:

本题解析:略
本题难度:一般
3、选择题 向一定量的CuSO4溶液中加入一定量的铁粉充分反应,可能出现的情况是
①溶液中的金属离子有Fe2+、Cu2+,不溶物是Cu
②溶液中的金属离子有Fe2+、Cu2+,不溶物是Fe
③溶液中的金属离子只有Cu2+,不溶物是Fe
④溶液中的金属离子只有Fe2+,不溶物是Fe、Cu
A.①③
B.①④
C.②③
D.③④
参考答案:B
本题解析:如果加入铁不足时,溶液中的金属离子有Fe2+、Cu2+不溶物是Cu;与硫酸铜恰好反应完时,溶液中只有Fe2+,不溶物为Cu;铁过量时,溶液中的金属离子只有Fe2+,不溶物为Cu和Fe。
点评:金属与酸,或与盐反应时,如果一种金属剩余,则能与该金属反应的物质都被反应完了,即排在该金属后面的金属阳离子不能存在.
本题难度:简单
4、选择题 下列变化不能通过一步实验直接完成的是?
[? ]
A.Fe?→?Fe3O4?
B.Fe(OH)3?→?Fe2O3?
C.Al?→?Al(OH)3?
D.Na2O2?→?Na2CO3
参考答案:C
本题解析:
本题难度:一般
5、简答题 (14分)碱式硫酸铁[Fe(OH)SO4]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:

部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
请回答下列问题:
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作__________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)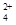 ,该水解反应的离子方程式为________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________。
Fe(OH)3的Ksp=____________。(提示,开始沉淀c(Fe3+)浓度为1.0×10-5mol/L)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO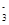 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
参考答案:(1)①4.4~7.5 ②H++HCO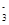 ===CO2↑+H2O,Al3++3HCO===Al(OH)3↓+3CO2↑
===CO2↑+H2O,Al3++3HCO===Al(OH)3↓+3CO2↑
(2)氧化剂 2 mol
(3)2Fe(OH)2++2H2O Fe2(OH)
Fe2(OH)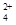 +2H+;10-37.4
+2H+;10-37.4
(4)酸性KMnO4溶液或铁氰化钾。
本题解析:(1)根据工艺流程可知加NaHCO3除去Al3+保留Fe2+,因而要控制pH使Al3+完全沉淀,而Fe2+不沉淀。(2)反应Ⅱ中通入的O2与NaNO2均作氧化剂,根据得失电子守恒,可以计算出标准状况下11.2 L O2与2 mol NaNO2得到的电子数相等。(3)依据原子守恒及电荷守恒可以写出Fe(OH)2+水解生成Fe2(OH)的离子方程式:2Fe(OH)2++2H2O Fe2(OH)
Fe2(OH)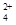 +2H+。pH=3.2时完全沉淀,c(H+)=10-3.2mol/L,c(OH-)=10-10.8mol/L,Ksp=c(Fe3+)·c3(OH-)=10-5×(10-10.8)3=10-37.4。(4)因产品中含Fe3+,可以用酸性KMnO4溶液检验Fe2+的存在,如含有Fe2+,则滴入几滴酸性KMnO4溶液后,溶液的紫色会褪去,否则不褪色。也可用铁氰化钾,溶液出现蓝色沉淀含有Fe2+,否则不产生蓝色沉淀
+2H+。pH=3.2时完全沉淀,c(H+)=10-3.2mol/L,c(OH-)=10-10.8mol/L,Ksp=c(Fe3+)·c3(OH-)=10-5×(10-10.8)3=10-37.4。(4)因产品中含Fe3+,可以用酸性KMnO4溶液检验Fe2+的存在,如含有Fe2+,则滴入几滴酸性KMnO4溶液后,溶液的紫色会褪去,否则不褪色。也可用铁氰化钾,溶液出现蓝色沉淀含有Fe2+,否则不产生蓝色沉淀
本题难度:简单