1、填空题 某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
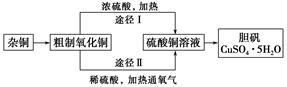
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于?上(用以下所给仪器的编号填入,下同),取用坩埚应使用?,灼烧后的坩埚应放在?上,不能直接放在桌面上。
实验所用仪器:
a.蒸发皿
b.石棉网
c.泥三角
d.表面皿
e.坩埚钳
f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是?。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、?、冷却结晶、?、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是?、?。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行?次。
(6)若测定结果x值偏高,可能的原因是?(填字母编号)。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
2、填空题 (10分)下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质

(1)①的化学式为?,⑤和⑥反应的化学方程式为?。
(2)实验室由⑧制取⑨的离子方程式为?,
⑨转变为⑩的化学方程式为?。
由⑨转变为⑩的反应现象为?
3、计算题
(一)制取CuO
实验步骤:①称取5 g CuSO4·5H2O,研细后倒入烧杯中,加30 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀为止,然后将
所得混合物转移到蒸发皿中,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题
(1)上述实验步骤中需要使用玻璃棒的是?(填实验步骤序号),
研磨固体所用仪器的名称是?
(2)步骤③中洗涤沉淀的操作方法是?
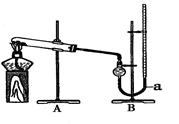
(二)催化效果比较
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
实验
| KClO3质量
| 其它物质的量
| 待测数据
|
实验Ⅰ
| 1.2g
| 无其他物质
| ?
|
实验Ⅱ
| 1.2g
| CuO ?0.5g
| ?
|
实验Ⅲ
| 1.2g
| MnO2 0.5g
| ?
|
?回答下列问题:
(3)上表所列实验中的“待测数据”指?
(4)量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是
?(填“酸式”或“碱式”)滴定管。
(5)若要证明实验Ⅱ中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管a,拔去干燥管上单孔橡皮塞,?
(6)为探究CuO在实验Ⅱ中是否为催化剂,需补做如下实验(无需写出具体操作):
a.?,b.检验CuO的化学性质有没有改变。
4、填空题 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
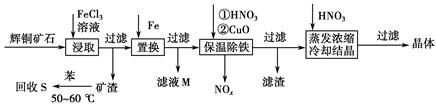
(1)写出浸取过程中Cu2S溶解的离子方程式___________________________。
(2)回收S过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是____________________、____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为______________________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是____________________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是______________________________。
5、填空题 硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:

(1)实验室实现“操作Ⅰ”所用的玻璃仪器有 、玻璃棒和烧杯。“操作Ⅲ”系列操作名称依次为 、 、过滤和洗涤。?
(2)“酸溶”过程中Fe3O4溶解的化学反应方程式为?。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是?。
(4)实验室检验“反应Ⅰ”已经完全的试剂是 ,现象是?。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式:?。