1、简答题 写出下列物质或微粒的电子式
①H______Na+______?Cl-______
②H2O______?HCl______MgCl2______.
2、选择题 下列各数值表示有关元素的原子序数,它们所表示的各组原子中,能以共价键相互结合形成稳定化合物的是( )
A.11与9
B.17与17
C.16与8
D.2与8
3、选择题 某碳氢化合物分子的结构式如图: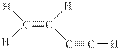 ,下列有关该分子的叙述正确的是(?)
,下列有关该分子的叙述正确的是(?)
A.该分子含5个σ键,3个π键
B.该分子是非极性分子
C.该分子的碳原子均是以 sp2杂化轨道参与成键
sp2杂化轨道参与成键
D.分子中有4个原子在同一直线上
4、填空题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原予核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:? (答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是?,A、B、C、D的第一电离能由小到大的顺序为?。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是?;
(3)A的最高价含氧酸根离子中,其中心原子采取?杂化,D的低价氧化物分子的空间构型是?。
(4)A、E形成某种化合物的晶胞结构如下图所示,则其化学式为?;(每个球均表示1个原子)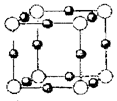
5、简答题 A~E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
| 元素 | A | B | C | D | E
有关性质或结构信息
单质是空气中主要成分之一,其氢化物水溶液呈碱性
原子核外有两个未成对电子
日常生活中常见的金属,通常用电解法冶炼其单质
其简单阴离子带两个单位负电荷
单质有毒,常温下为有色气体,常用于自来水消毒
|
请结合表中信息完成下列各小题:
(1)C在元素周期表中的位置是______,D的简单阴离子的核外电子排布式为______.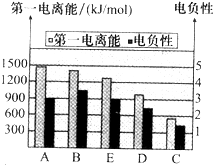
(2)如图是A~E的第一电离能和电负性数据,请回答:
①E的第一电离能大于D,其原理是(根据它们在周期表中的位置解释)______.
②A、B、D三种元素的非金属性由强到弱的顺序是______.
(3)A的常见单质分子有多个共价键.
①常温下,该单质化学性质很稳定,是因为______.
②该单质分子中σ键与π键的数目之比为______.
(4)写出C、E形成的化合物与A的氢化物在水溶液中反应的离子方程式______.