1、简答题 (1)已知某反应的各物质浓度数据如下:aA(g)+bB(g)

2C(g)
起始浓度(mol/L):1.5?1.0?0
2s末浓度(mol/L):0.9?0.8?0.4
则①a=______,b______.
②2S内B的反应速率=______.
(2)由碳棒,铁片和200mL?1.5mol/L的稀硫酸组成的原电______池中,当在碳棒上产生气体3.36L(标准状况)时,求
③有______个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为______(不考虑溶液体积变化).
(3)将2.3g金属钠放入足量的m?g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是______(用含m的代数式表示)
参考答案:(1)①由题目数据可知,A的浓度变化量为1.5mol/L-0.9mol/L=0.6mol/L,B的浓度变化量为1.0mol/L-0.8mol/L=0.2mol/L,C的浓度变化量为0.4mol/L.
浓度变化量之比等于化学计量数之比,所以a:b:2=0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,所以a=3,b=1.
故答案为:a=3?b=1
②2S内B的反应速率v(B)=0.2mol/L2s=0.1mol/(L?S)
故答案为:0.1mol/(L?S)
(2)③碳棒上产生气体3.36L为氢气,反应转移的电子的物质的量为3.36L22.4L/mol×2=0.3mol,所以电线中通过的电子数目为0.3mol×6.02×1023mol-1=1.806×1023.
故答案为:1.806×1023
④根据H原子守恒可知,参加反应H+的物质的量为3.36L22.4L/mol×2=0.3mol,H+的物质的量浓度变化量△c(H+)=0.3mol0.2L=1.5mol/L,所以液中H+的物质的量浓度c(H+)=1.5mol/L×2-1.5mol/L=1.5mol/L.
故答案为:1.5mol/L
(3)n(Na)=2.3g23g/mol=0.1mol
根据Na原子守恒n(NaOD)=n(Na)=0.1mol,所以m(NaOD)=0.1mol×41g/mol=4.1g;
根据转移电子守恒n(D2)=12n(Na)=12×0.1mol=0.05mol,所以m(D2)=0.05mol×4g/mol=0.2g;
溶液中溶质的质量分数为4.1g2.3g+mg-0.2g×100%=4.12.1+m×100%?
故答案为:4.12.1+m×100%
本题解析:
本题难度:一般
2、简答题 自然界的矿物、岩石的成因和变化受到许多条件的影响.地壳内每加深1km,压强增大约25000~30000kPa.在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)

SiF4(g)+2H2O(g)+148.9kJ
根据题意完成下列填空:
(1)在地壳深处容易有______气体逸出,在地壳浅处容易有______沉积.
(2)如果上述反应的平衡常数K值变大,该反应______(选填编号).
a.一定向正反应方向移动?b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动?d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号).
a.2v正(HF)=v逆(H2O)?b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变?d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为______.
参考答案:(1)SiO2(s)+4HF(g)

SiF4(g)+2H2O(g)+148.9kJ该反应为正反应体积减小的反应,增大压强,平衡向右移动,有SiF4(g)逸出,H2O(g)凝结为水,减小压强有SiO2(s)沉淀析出;故在地壳深处容易有SiF4、H2O 气体逸出,在地壳浅处容易有 SiO2沉积.
(2)化学平衡常数只随温度的变化而变化,该反应为放热反应,平衡常数K值变大说明温度降低平衡右移,温度降低反应速率减小,平衡右移逆反应速率增大,故a、d正确;
(3)建立平衡的标志有两个:正反应速率═逆反应速率、各物质的浓度保持不变;v正(HF)=2v逆(H2O)、
v(H2O)=2v(SiF4)、SiO2的质量保持不变均达到平衡;故b、c正确;
(4)由容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,
则增加的质量为2.0L×0.12g/L=0.24g,由反应及元素守恒可知,每4molHF反应气体质量增加28+16×2=60g,
设参加反应的HF的物质量为x,
SiO2(s)+4HF(g)

SiF4(g)+2H2O(g)△m
? 4mol? 1mol? 2mol?60g
? x? ?0.24g
4molx=60g0.24g,解得x=0.016mol,
v(HF)=△C△t=0.016mol2L?8.0min=0.0010mol/(L?min)
故答案为:(1)SiF4、H2O;SiO2;(2)a、d;(3)b、c;(4)0.0010mol/(L?min).
本题解析:
本题难度:一般
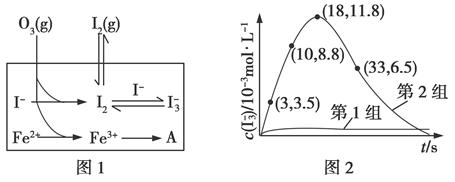
3、填空题 大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。
编号
| 反应物
| 反应前pH
| 反应前pH
|
第1组
| O3+I-
| 5.2
| 11.0
|
第2组
| O3+I-+Fe2+
| 5.2
| 4.1
|
?
①第1组实验中,导致反应后pH升高的原因是______________。
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________。
③第2组实验进行18 s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小
B.c(I-)减小
C.I2(g)不断生成
D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
参考答案:(1)O3(g)+2I-(aq)+2H+(aq)=O2(g)+I2(aq)+H2O(l) ΔH1+ΔH2+ΔH3
(2)K=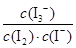
(3)①H+被消耗,其浓度降低 ②Fe2+ Fe3+氧化I-生成I2,使I-的转化率显著提高 ③BD
(4)反应时间:18 s-3 s=15 s,I3-浓度变化:11.8×10-3mol·L-1-3.5×10-3mol·L-3mol·L-1=8.3×10-3mol·L-1,v(I3-)=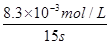 ≈5.5×10-4mol·(L·s)-1
≈5.5×10-4mol·(L·s)-1
本题解析:利用盖斯定律、化学反应速率、化学平衡的影响因素等分析及计算,逐步解决问题。
(1)根据盖斯定律,由①+②+③可得总反应为2I-(aq)+O3(g)+2H+(aq)=I2(aq)+O2(g)+H2O(l),则ΔH=ΔH1+ΔH2+ΔH3。(2)所给反应的平衡常数表达式为K=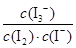 。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图1中的A为Fe2+,由Fe3+生成Fe2+的过程中,I-被氧化为I2,因此I-的转化率显著提高。③导致I3-浓度下降的原因是c(Fe3+)增加,使c(I-)减小,平衡I2(aq)+I-(aq )?I3-(aq)逆向移动。(4)v(I3-)=
。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图1中的A为Fe2+,由Fe3+生成Fe2+的过程中,I-被氧化为I2,因此I-的转化率显著提高。③导致I3-浓度下降的原因是c(Fe3+)增加,使c(I-)减小,平衡I2(aq)+I-(aq )?I3-(aq)逆向移动。(4)v(I3-)=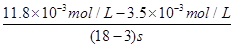 ≈5.5×10-4mol·(L·s)-1。
≈5.5×10-4mol·(L·s)-1。
点拨:知识:反应热、化学反应速率、化学平衡常数。能力:考查考生对化学反应原理的理解能力。试题难度:中等。
本题难度:一般
4、选择题 某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
A.0.04
B.0.04mol/(L.s)
C.0.08mol/(L.s)
D.0.04mol/L
参考答案:20s内该物质的浓度变化为△c=1.0mol/L-0.2mol/L=0.8mol/L.
所以20s内该物质的反应速率为0.8mol/L20s=0.04mol/(L?s).
故选:B.
本题解析:
本题难度:简单
5、选择题 20 ℃ 时,将0.1 mol/L Na2S2O3溶液10mL 和 0.1 mol/L H2SO4溶液10mL混合,2 min 后溶液出现明显浑浊(发生的反应为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)。已知温度每升高10 ℃ ,该反应的化学反应速率增大到原来的2倍。那么50 ℃时,同样的反应要明显地出现浑浊,所需时间是
A.48s
B.40s
C.20s
D.15s
参考答案:D
本题解析:温度每升高10 ℃ ,反应的化学反应速率增大到原来的2倍,温度升高30℃,速率为原来的8倍,时间为原来的1/8,需要的时间为15s。
本题难度:一般