1、选择题 在0.1mol/L的氨水中存在 NH3·H2O  ?NH4++OH-的电离平衡,下列措施都能使该平衡向右移动的一组是 (? )
?NH4++OH-的电离平衡,下列措施都能使该平衡向右移动的一组是 (? )
①加入少量HCl? ②加入固体NaOH? ③加水? ④通入氨气
⑤加热升高温度? ⑥加入NH4NO3
A.①③④⑤
B.①③④⑤⑥
C.②③④⑤
D.①③④⑥
参考答案:A
本题解析:向氨水中加入盐酸,H+与OH-反应,平衡向右移动;加氢氧化钠固体,c(OH-)增大,平衡向左移动;加水稀释,促进电离,平衡向右移动;通入氨气,c(NH3·H2O)增大,平衡向右移动;电离过程是吸热过程,升高温度,平衡向右移动;加入硝酸铵,c(NH4+)增大,平衡向左移动。
点评:勒沙特列原理同样适用于弱电解质电离平衡。
本题难度:一般
2、选择题 当NaOH溶液与氨水的pH、体积都相同时,下列叙述正确的是
[? ]
A.两溶液的物质的量浓度相同
B.两溶液的c(H+)相同
C.用同浓度盐酸中和时,消耗酸的体积相同
D.升高温度10℃,两者pH仍相等
参考答案:B
本题解析:
本题难度:一般
3、选择题 在RNH2·H2O RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
A.通入HCl
B.加少量NaOH固体
C.加水
D.升温
参考答案:D
本题解析:A、通入HCl,平衡右移,但是氢氧根离子浓度减小,错误;B、加少量NaOH固体,平衡左移,错误;C、加水电离程度增大,但是氢氧根离子浓度减小,错误;D、升温,平衡右移,RNH2·H2O的电离程度及c(OH-)都增大,正确。。
本题难度:一般
4、选择题 两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是( )
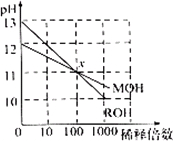
A.MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10?c(MOH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的?10倍
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列叙述中,能证明某物质是弱电解质的是
A.熔化时不导电
B.不是离子化合物,而是极性共价化合物
C.溶液中已电离的离子和未电离的分子共存
D.水溶液的导电能力很差
参考答案:C
本题解析:A、熔化时不导电,说明没有自由移动的离子,但不是弱电解质的特征,如蔗糖是非电解质,HCl为强电解质,熔化时不导电,故A错误。B、电解质的强弱是根据其电离程度划分的,与是离子化合物还是共价化合物无关,故B错误;C、弱电解质是指:在水溶液里部分电离的电解质.既有电解质的分子又有弱电解质电离出的离子,如水就是,水是弱电解质,既有水分子,又有水电离出的氢离子和氢氧根离子,所以稀溶液中已电离的离子和未电离的分子共存是弱电解质,故C正确;D、水溶液的导电能力与溶液中的离子浓度有关,离子浓度大,导电能力强,如硫酸钡是强电解质,在水中难溶,水中离子浓度小,导电能力弱,所以水溶液的导电能力的不一定是弱电解质,故D错误。
本题难度:一般