1、选择题 下列叙述中正确的是( )
A.体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)
C.25℃,pH=9的NaOH溶液和NaAc溶液中,由水电离出的c(H+)均为10-5mol?L-1
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)该式只能满足NaHCO3溶液中的离子浓度关系
参考答案:A、体积相同、浓度均为0.1mol/L的NaOH溶液、氨水都是一元碱,氢氧化钠是强碱,氨水是弱碱存在电离平衡,稀释相同倍数时,氨水溶液中的氢氧根离子浓度大,分别稀释m倍、n倍,溶液的pH都变成9时,氨水需要稀释的倍数比氢氧化钠溶液要大,即 m>n,故A错误;
B、甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,说明甲溶液中氢离子浓度大,醋酸溶质浓度甲大于乙溶液,与相同量氢氧化钠反应时,醋酸和氢氧化钠溶质按1:1反应,所以需要的溶液的体积应是V(乙)>10V(甲),故B正确;
C、25℃时溶液中存在离子积Kw=[H+][OH-]=10-14,pH=9的NaOH溶液中水电离出的[H+]=10-9mol/L,pH=9的NaAc溶液中[H+][OH-]水=10-14,所以水电离出的[H+]水=[OH-]水=10-1410-9=10-5mol/L,故C错误;
D、碳酸钠溶液中存在的阴阳离子与碳酸氢钠溶液相同,所以溶液中的电荷守恒都是c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选B.
本题解析:
本题难度:简单
2、填空题 写出下列物质在水中的电离方程式:
(1)Na2SO4?(2)CH3COOH?
参考答案:
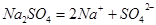 ? CH3COOH
? CH3COOH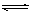 CH3COO- + H+
CH3COO- + H+
本题解析:Na2SO4为强电解质,在水溶液中完全电离;醋酸是弱电解质,在水溶液中部分电离,故用可逆符号。
点评:强弱电解质是历年高考重点,考生可根据物质的分类来判断熟记哪些是强电解质、哪些是弱电解质。
本题难度:一般
3、选择题 柠檬酸(三元弱酸)可预防和治疗高血压,将0.1mol/L的柠檬酸水溶液加水稀释,该过程中下列微粒浓度增大的是( )
A.柠檬酸分子
B.柠檬酸根
C.H+
D.OH-
参考答案:柠檬酸是弱酸,加水稀释能促进其电离,但柠檬酸根离子、氢离子、柠檬酸分子浓度都减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 在0.1mol·L-1CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.加入水时,平衡向生成CH3COOH的方向移动
B.加入少量NaOH固体,平衡向电离的方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向电离的方向移动
参考答案:B
本题解析:A.加入水时,由于生成物的浓度减小的多,反应物的浓度减小的少,所以电离平衡向电解质电离的方向移动。错误。B.加入少量NaOH固体,由于发生反应:OH-+H+=H2O。使c(H+)减小。减小生成物的浓度,化学平衡正向移动,即平衡向电离的方向移动。正确。C.加入少量0.1mol·L-1HCl溶液,c(H+)增大,平衡逆向移动,减小这种增大的趋势,但是总的来说,溶液中c(H+)还是增大。错误。D.加入少量CH3COONa固体,溶液则c(CH3COO-)增大,电离平衡逆向移动,对醋酸的电离起到了抑制作用。正确。
本题难度:一般
5、选择题 pH=3的盐酸aL分别与下列三种溶液充分反应后溶液呈中性:
①pH=11的氨水bL;②物质的量浓度为1×10-3mol/L的氨水cL;③c(OH-)= 1×10-3mol/L的Ba(OH)2溶液dL
试判断a、b、c、d的大小关系为
[? ]
A.c>a=d>b
B.b>a=d>c
C.c>a>d>b
D.a=b>c>d
参考答案:A
本题解析:
本题难度:一般