1、选择题 质量数为A的某金属阳离子Mn+核外共有b个电子,则M的核内中子数为(?)
A.A-b+n
B.A-b-n
C.A+b-n
D.A+b+n
2、选择题 铀 是重要的核工业原料,在自然界中的含量很低。下列有关铀
是重要的核工业原料,在自然界中的含量很低。下列有关铀 的说法正确的是
的说法正确的是
A.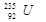 与
与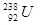 的性质完全相同
的性质完全相同
B.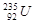 原子核中含有143个中子
原子核中含有143个中子
C. 属于短周期元素
属于短周期元素
D.1mol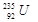 的质量是143g
的质量是143g
3、填空题 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请回答:
族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
2
| ?
| ?
| ?
| ⑤
| ?
| ⑥
| ?
| ?
|
3
| ①
| ③
| ④
| ?
| ?
| ?
| ⑦
| ⑨
|
4
| ②
| ?
| ?
| ?
| ?
| ?
| ⑧
| ?
|
(1)这九种元素中(填元素符号)⑤是?,其中化学性质最不活泼的是?。
⑤和⑥形成化合物的电子式?
(2)在这些元素的最高价氧化物对应的水化物中,碱性最强的是(填化学式)。?
酸性最强的是?呈两性的是?,写出三者之间相互反应的化学方程式??;
?
?
(3)①、②、③三种元素按原子半径由大到小的顺序依次为?(填元素符号)。
(4) 用电子式表示⑧元素与③元素形成化合物的过程?。
(5) 在①和②中化学性质最活泼的是?
(6)在⑦和⑧中化学性质最活泼的是?,用化学实验证明的方法和离子方程式:
方法?
离子方程式??
4、填空题 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
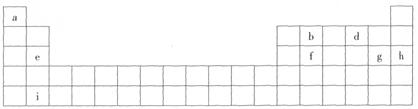
(1)在以上字母表示的短周期主族元素中,原子半径最大的是__________(填元素符号)。
(2)i元素在周期表中的位置是__________。运用元素周期律判断,i元素的正二价硫酸盐是__________(难溶或易溶)于水的固体。
(3)请用电子式表示a与g组成的化合物的形成过程____________________。
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式____________________;X与d的单质在加热条件下生成的化合物中存在的化学键类型是____________________。
(5)工业上制取Y和g的无水化合物方法如下:Y的氧化物与b、g的单质在高温条件下反应,每消耗6 kg b的单质,过程中转移1×10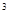 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。
5、选择题 以下性质的比较中,正确的是(? )
A.最高正价:F>O>N
B.原子半径:P> N > O
C.熔点:Mg>Na>Li
D.密度:苯>水>四氯化碳