1、选择题 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是(? )

A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+
参考答案:B
本题解析:液滴边缘O2多,发生正极反应O2+2H2O+4e-=4OH-。液滴下的Fe发生负极反应Fe-2e-=Fe2+,为腐蚀区(a)。A项错误,Cl-由b区向a区迁移;C项错误,液滴下的Fe因发生氧化反应而被腐蚀;D项错误,Cu不如Fe活泼,作正极,负极反应为Fe-2e-=Fe2+。
本题难度:一般
2、选择题 海水中溶解和悬浮着大量的无机物与有机物,具有巨大的开发潜力,人类除了从海水中获得食盐和水外,还获得大量的钾、镁、溴、碘等,以下说法不正确的是?(?)
A.钾与溴两种元素位于周期表中同一周期,二者形成的化合物中只有离子键
B.轮船在海水中与在江河中航行相比,在海水中更易被腐蚀
C.若氯有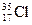 、
、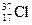 两种核素,则
两种核素,则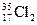 、
、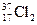 化学性质几乎相同
化学性质几乎相同
D.海水中的上述元素变成单质状态过程中,均发生了氧化反应
参考答案:D
本题解析:钾是活泼金属,溴是活泼非金属,二者能形成离子键,A对;轮船在海水中易形成原电池,加速了轮船的腐蚀速率,B对;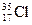 、
、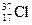 的电子层结构相同,它们各自形成的单质化学性质基本相同,C对;海水中的钾、镁元素是以正价状态存在的,变化单质的过程中,化合价降低,发生还原反应,D错。
的电子层结构相同,它们各自形成的单质化学性质基本相同,C对;海水中的钾、镁元素是以正价状态存在的,变化单质的过程中,化合价降低,发生还原反应,D错。
本题难度:简单
3、选择题 下列用来表示物质变化的化学用语中,正确的是( )
A.钢铁发生电化学腐蚀的正极反应式为:Fe-2e-=Fe2+
B.氢氧燃料电池的负极反应式为:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
参考答案:D
本题解析:钢铁发生电化学腐蚀时,铁作负极,失去电子,负极电极反应式是Fe-2e-=Fe2+,A不正确;在氢氧燃料电池中,氧气在正极通入,氢气在负极通入,B不正确;粗铜精炼时,与电源正极相连的是粗铜,选项C不正确;电解池中阳极失去电子,发生氧化反应,则电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑,D正确,答案选D。
点评:该题是基础性试题的考查,难度不大。明确原电池和电解池的工作原理是答题的关键,有利于培养学生的逻辑思维能力和应试能力,注意相关知识的积累和总结。
本题难度:一般
4、选择题 下列说法正确的是(? )
A.同温同压下,H2 + Cl2 = 2HCl在光照和点燃条件的△H不同
B.粗铜精炼时,与电源负极相连的是粗铜
C.船底镶嵌锌块,锌作负极,以防船体被腐蚀
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源
参考答案:C
本题解析:反应的焓变(△H)与物质的量有关,而与反应条件无关,故A错误;
粗铜精炼时,粗铜做电解池的阳极(主反应为:Cu-2e-=Cu2+),应与外加电源的正极相连,故B错误;
船底镶嵌锌块,构成锌-铁原电池,锌比铁活泼,故锌作负极:Zn-2e-=Zn2+,铁作正极受到保护,C正确;
天然气、沼气和水煤气分别属于化石能源、可再生能源和二级能源,故D错误;
本题难度:一般
5、选择题 下列条件下铁钉最容易生锈的是
A.浸泡在海水中
B.浸泡在植物油中
C.置于干燥的空气中
D.浸泡在蒸馏水中
参考答案:A
本题解析:铁钉浸泡在海水中,将构成原电池,而原电池能加快反应速率,故最容易生锈;
本题难度:简单