1、选择题 下列说法不正确的是
[? ]
A.铁管道与直流电源负极相连,防止铁管道腐蚀
B.小苏打、氢氧化铝可用于治疗胃酸过多
C.工业生产中,常将氯气通入澄清石灰水中,制取漂白粉
D.除去氯化钙溶液中的少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤
参考答案:D
本题解析:
本题难度:简单
2、填空题 (10分)将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。

在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下:
金属
| 电子流动方向
| 电压/V
|
A
| A→Cu
| +0.78
|
B
| Cu→B
| -0.15
|
C
| C→Cu
| +1.35
|
D
| D→Cu
| +0.30
|
?已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
请根据表中数据回答下列问题。
(1)__________金属可能是最强的还原剂;_______金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润, 则在滤纸上能看到有蓝色沉淀析出的金属是__________(填字母)。其对应电池的电极反应式为:
则在滤纸上能看到有蓝色沉淀析出的金属是__________(填字母)。其对应电池的电极反应式为:
负极: _______________________;?正极: ________________________。
参考答案:(10分)
(1)C? B? (2)B? 2Cu+4OH――4e-====2Cu(OH)2↓? 2H2O+O2+4e-====4OH-
本题解析:略
本题难度:一般
3、实验题 (14分)如何防止铁的腐蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
序号
| 内容
| 实验现象
|
1
| 常温下将铁丝放在干燥空气中一个月
| 干燥的铁丝表面依然光亮
|
2
| 常温下将铁丝放在潮湿空气中一小时
| 铁丝表面依然光亮
|
3
| 常温下将铁丝放在潮湿空气中一个月
| 铁丝表面已变得灰暗
|
4
| 将潮湿的铁丝放在常温的氧气流中一小时
| 铁丝表面略显灰暗
|
5
| 将潮湿的铁丝放在高于常温的氧气流中一小时
| 铁丝表面已变得灰暗
|
6
| 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时
| 铁丝表面灰暗程度比实验5严重
|
回答以下问题:
⑴上述实验中发生了电化学腐蚀的是(填实验序号)?,在电化学腐蚀中,负极反应是_______________?,正极反应是_______________??。
⑵由该实验可知,可以影响铁锈蚀速率的因素是?。
⑶下列对金属制品采取的防护方法不正确的是?(填序号)。
A.在电线的外面包上一层塑料层?
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
参考答案:⑴3、4、5、6?(4分)Fe-2e-=Fe2+(或2Fe-4e-=2Fe2+),2H2O+O2+4e-=4OH- (4分)
⑵湿度、温度、O2的浓度、电解质溶液(4分)?⑶C(2分)
本题解析:(1)在潮湿的环境中,不纯的金属或合金容易发生电化学腐蚀。所以根据实验中的环境和实验现象可知,发生电化学腐蚀的是3、4、5、6。铁属于活泼的金属,在电化学腐蚀中,铁是负极,失去电子,发生氧化反应,电极反应式为Fe-2e- Fe2+。由于溶液的酸性很弱,所以主要是吸氧腐蚀,因此正极反应式为2H2O+O2+4e-=4OH-。
Fe2+。由于溶液的酸性很弱,所以主要是吸氧腐蚀,因此正极反应式为2H2O+O2+4e-=4OH-。
(2)根据实验中的环境和实验现象可知,影响铁锈蚀速率的因素有湿度、温度、O2的浓度、电解质溶液等。
(3)由于铁的活泼性强于铜,所以如果在海轮的铁制外壳上焊上铜块,则此时铁是负极,加速腐蚀,C是不正确的,AB正确,答案选C。
本题难度:一般
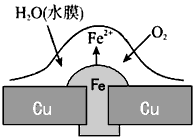
4、选择题 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是
[? ]
A.正极的电极反应式为:2H++2e-=H2↑
B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe流向Cu
参考答案:B
本题解析:
本题难度:一般
5、填空题 (12分)“生物质"是指由植物或动物生命体衍生得到的物质的总称。“生物质能”是人类解决能源危机的一种重要的能源。“生物质”在一定条件下可气化为CO、H2等原料气,进而合成甲醇和二甲醚(CH3OCH3),相关反应为:
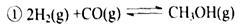 ?
?
请根据图示回答问题:
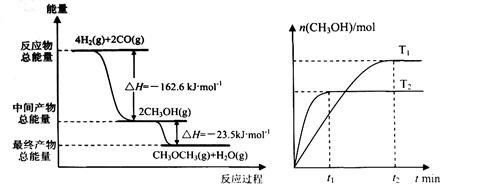
(1) 由H2和CO合成二甲醚的热化学方程式是 ?。?
(2) 在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成甲醇,则T1、T2温度下对应反应的平衡常数K1_______K2(选填“<”、“>”或“=”)。
(3) 在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),经一定时间反应②达到平衡状态,此时测得混合气体密度是相同条件下起始时的1.6倍。反应开始时正、逆反应速率的大小关系为V(正)_______V(逆)(选填“ >”、“< ”或“=”),平衡时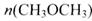 =_________mol。
=_________mol。
(4) 右图为绿色电源“二甲醚燃料电池”的工作原理示意图。(a、b均为多孔性Pt电极)

b电极是_______极:(填“正”或“负”)
a电极上的电极反应为___?____。
参考答案:(12分)(1)? 4H2(g)+2CO(g)  ?CH3OCH3(g)+H2O(g)?△H=-186.1 kJ/mol
?CH3OCH3(g)+H2O(g)?△H=-186.1 kJ/mol
(2)?﹥? (3)?﹥?; 1.75(4)正? CH3OCH3 – 12e- +3H2O = 2CO2 + 12H+
本题解析:(1)根据图像可知,该反应的反应热△H=-162.6kJ/mol-23.5 kJ/mol=-186.1 kJ/mol,所以该反应的热化学方程式是4H2(g)+2CO(g)  ?CH3OCH3(g)+H2O(g)?△H=-186.1 kJ/mol。
?CH3OCH3(g)+H2O(g)?△H=-186.1 kJ/mol。
(2)根据图像可知T2曲线首先达到平衡状态,说明T2>T1。但温度越高,甲醇的物质的量越少,这说明升高温度,平衡向逆反应方向移动,即正反应是放热反应,所以K1>K2。
(3)根据方程式可知,该反应是体积减小的。由于气体的质量不变,所以如果平衡时混合气体密度是相同条件下起始时的1.6倍,就说明反应是向正反应方向进行的,因此反应开始时正、逆反应速率的大小关系为V(正) >V(逆)。?4H2(g)+2CO(g)  ?CH3OCH3(g)+H2O(g)
?CH3OCH3(g)+H2O(g)
起始量(mol) 4? 2? 1?1
转化量(mol) 4x? 2x? x? x
平衡量(mol)4-4x? 2-2x? 1+x? 1+x
则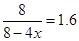
解得x=0.75mol
所以平衡时二甲醚的物质的量是1.75mol
(4)氧气得到电子,在正极通入,所以b电极是正极;a电极是负极,二甲醚失去电子,由于存在质子交换膜,所以负极电极反应式是CH3OCH3-12e-+3H2O =2CO2+12H+。
点评:该题是高考中的常见题型,试题综合性强,难度较大。试题注重基础和能力的双向考查,有利于培养学生分析问题、解决问题的能力,也有助于培养学生的应试能力,提高学生的学习效率。
本题难度:一般