1、选择题 家蝇的雌性信息素可用芥酸(来自菜籽油)与羧酸X在浓NaOH溶液中进行阳极氧化得到。电解总反应式为: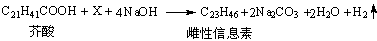 。则下列说法正确的是
。则下列说法正确的是
[? ]
A.X为C2H5COOH
B.电解的阳极反应式为:
C.电解过程中,每转移a mol电子,则生成0.5a mol 雌性信息素
D.阴极的还原产物为H2和OH-
参考答案:AC
本题解析:
本题难度:一般
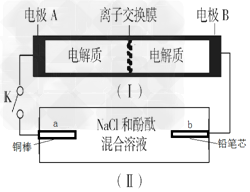
2、选择题 下图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是?
Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是?
[? ]
A.当有0.01?mol?Na+通过离子交换膜时,b电极上析出标准状况下的气体112?mL
B.负极反应为4Na-4e-=4Na+
C.闭合K后,b电极附近的pH变小
D.闭合K后,a电极上有产生氢气
参考答案:A
本题解析:
本题难度:一般
3、简答题 硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
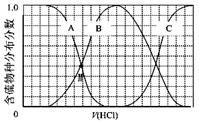 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为
 (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:

① 写出反应器中发生反应的化学方程式是 。
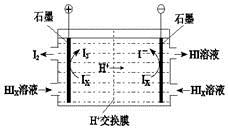
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
参考答案:(1)xCOS(g)=XCO(g)+Sx(s)△H=0.5x(b-a)akJ/mol
(2)3NA
(3) ①HS-(或NaHS)
② c
③ c(Na+)>c(HS-)>c(S2-)>c(OH-)> c(H+)
(4)①SO2+xI2+2H2O=H2SO4+2HIx
②2Ix—-2e-=xI2 2HIx=(x-1)I2+2HI
本题解析:(1)①SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
②2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。由盖斯定律可得,xCOS(g)=Xco(g)+Sx(s)△H=0.5x(b-a)akJ/mol;
(2)根据As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,若生成H3AsO4的物质的量为2mol时,电子转移为10mol,若生成H3AsO4的物质的量为0.6mol时,电子转移为3NA;
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量发生的反应依次为,NaOH+HCl=NaCl+H2O、Na2S+HCl=NaCl+NaHS、NaHS+HCl=H2S+NaCl。①结合图像分析,B表示HS-;②根据元素守恒知,滴加过程中,溶液中微粒浓度大小关系为c(Na+)=3[c(H2S)+c(HS?)+c(S2?)],选c;③A表示Na2S,B表示NaHS,当滴加盐酸至M点时,表示两者含量相等,溶液中
c(Na+)=3[c(H2S)+c(HS?)+c(S2?)],则c(Na+)>c(HS-),NaHS溶液呈碱性,说明其水解大于电离,水解是微弱的,所以c(HS-)>c(S2-),硫化钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),则c(Na+)>c(HS-)>c(S2-)>c(OH-)> c(H+);
(4)由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+xI2+2H2O=H2SO4+2HIX;②由题给装置图可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix--2e-=xI2,电解HIx生成I2、HI,反应方程式为:2HIx
本题难度:一般
4、填空题 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:

Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如图所示装置进行电化学浸出实验。将精选黄铜矿粉加入电解槽的阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。? Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。? Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:CuFeS2 + 4H+=Cu2+ + Fe2+ + 2H2S↑? 2Fe3+ + H2S=2Fe2+ + S↓+ 2H+ ,阳极区硫酸铁的主要作用是?。(2)阴极区,电极上开始时有大量气泡产生,后有红色固体析出,一段时间后红色固体溶解。写出析出红色固体的反应方程式?。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是?。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是?。(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是?。
参考答案:(1)吸收硫化氢气体,防止环境污染(表述合理即可得分) (1分)
(2)Cu2++2e–=Cu?(2分)?(3)分液漏斗?(1分)
(4)增大H+浓度,使平衡2RH(有机相) + Cu2+(水相) R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生?(2分) ?(5)c(H+)>c(SO42–)>c(Cu2+)>c(OH–)?(2分)
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生?(2分) ?(5)c(H+)>c(SO42–)>c(Cu2+)>c(OH–)?(2分)
本题解析:(1)反应CuFeS2 + 4H+=Cu2+ + Fe2+ + 2H2S↑中有H2S气体产生,H2S有毒属于大气污染物。根据反应2Fe3+ + H2S=2Fe2+ + S↓+ 2H+ 可知,阳极区硫酸铁的主要作用是吸收硫化氢气体,防止环境污染。
(2)电解池中阴极得到电子,发生还原反应。阴极析出红色固体,说明该红色固体是铜,因此电极反应式为Cu2++2e–=Cu。
(3)有机物不溶于水,分液即可,所以分离有机相和水相的主要实验仪器是分液漏斗。
(4)加入硫酸,增大溶液中H+浓度,使平衡2RH(有机相) + Cu2+(水相) R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生。
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生。
(5)200mL0.5 mol/L的CuSO4溶液中硫酸铜的物质的量=0.2L×0.5mol/L=0.1mol,生成铜3.2 g,物质的量=3.2g÷64g/mol=0.05mol。这说明反应中硫酸铜还有0.05mol没有被电解。根据方程式2CuSO4+2H2O 2Cu+2H2SO4+O2↑可知,溶液中还生成0.05mol硫酸。由于铜离子水解,则溶液中离子浓度大小顺序是)c(H+)>c(SO42–)>c(Cu2+)>c(OH–)。
2Cu+2H2SO4+O2↑可知,溶液中还生成0.05mol硫酸。由于铜离子水解,则溶液中离子浓度大小顺序是)c(H+)>c(SO42–)>c(Cu2+)>c(OH–)。
本题难度:一般
5、填空题 某化学兴趣小组用下图装置电解CuSO4溶液,测定铜的相对分子质量。

(1)若实验中测定在标准状况下放出的氧气的体积VL,A连接直流电源的__________ (填“正极”或“负极”)。
(2)电解开始一段时间后,在U形管中可观察到的现象-____________________________。
电解的离子方程式为?。
(3)实验中还需测定的数据是_______________(填写序号)。
①A极的质量增重m g?②B极的质量增重m g
(4)下列实验操作中必要的是____________(填字母)。
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解过程中电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干—称重一再烘干一再称重”进行