| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《电解池原理》考点特训(2019年冲刺版)(六)
参考答案:D 本题解析:A、锌比铜活泼,所以铜锌原电池中铜是正极,正确;B、用电解法精炼铜时粗铜作阳极,发生氧化反应,纯铜作阴极,发生还原反应得到单质铜,正确;C、电镀时,镀层金属作阳极,镀件作阴极,所以在镀件上镀铜时可用铜作阳极,正确;D、电解稀硫酸溶液制H2、O2时,若铜做阳极,则在阳极放电的是活性电极Cu,不是氢氧根离子,所以得不到氧气,错误,答案选D。 本题难度:一般 3、选择题 下列用来表示物质变化的化学用语中,正确的是 |
参考答案:A
本题解析:电解饱和食盐水时,阳极是Cl-失电子,发生氧化反应,故A正确;电池的正极得电子,发生还原反应,正极反应为O2 + 2H2O+ 4e- = 4OH-,故B错误;.粗铜精炼时,与电源正极相连的是粗铜,故C错误,原电池负极发生氧化反应,负极反应式:Fe-2e- =Fe2+,故D错误。
考点:本题考查电化学原理。
本题难度:一般
4、填空题 (选做题16分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-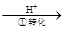 Cr2O72-
Cr2O72-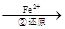 Cr3+
Cr3+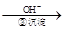 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同
B.2v (Cr2O72-)=" v" (CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要 mol的FeSO4 7H2O。
7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在沉淀溶解平衡,请写出其沉淀溶解平衡方程式
常温下,Cr(OH)3的溶度积Ksp=[Cr3+]·[OH?]3=10?32,要使c(Cr3+)降至10?5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因是 。
⑹在阴极附近溶液pH升高的原因是(用电极反应解释) ,溶液中同时生成的沉淀还有 。
参考答案:(1)橙 (2)c (3)6 (4) Cr(OH)3(s) Cr3+(aq)+3OH?(aq) 5
Cr3+(aq)+3OH?(aq) 5
(5)阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
(6)2H++2e-=H2↑ Fe(OH)3
本题解析:(1)pH=2,溶液呈酸性,所以显橙色;(2)根据平衡标志,浓度不变、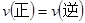 ;故溶液的颜色不变达到平衡;(3)根据得失电子守恒,Cr由+6价变为+3价,1molCr2O72-离子要得6mol电子,1mol的FeSO4
;故溶液的颜色不变达到平衡;(3)根据得失电子守恒,Cr由+6价变为+3价,1molCr2O72-离子要得6mol电子,1mol的FeSO4 7H2O 变为Fe3+,能失电子1mol,所以需要6mol FeSO4
7H2O 变为Fe3+,能失电子1mol,所以需要6mol FeSO4 7H2O;(4)Cr(OH)3在溶液中沉淀溶解平衡方程式Cr(OH)3(s)
7H2O;(4)Cr(OH)3在溶液中沉淀溶解平衡方程式Cr(OH)3(s) Cr3+(aq)+3OH?(aq) ;
Cr3+(aq)+3OH?(aq) ;
10?5×[OH?]3=10?32,[OH?]=10-9,所以PH应为5;(5)Fe做阳极,发生氧化反应,生成Fe2+,Fe2+还原Cr2O72-;⑹阴极发生还原反应,2H++2e-=H2↑,消耗氢离子,所以PH增大;Fe2+被氧化为Fe3+所以还生成Fe(OH)3沉淀。
考点:本题考查氧化还原、沉淀溶解平衡、电化学。
本题难度:困难
5、选择题 电解质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g/cm3),用铂作电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,此时溶液中符合下表关系的是
[? ]
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《化学平衡的.. | |