1、选择题 氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是
A.35Cl原子所含质子数为18?
B.1mol的1H35Cl分子所含中子数约为19×6.02×1023
C.3.5?g的35Cl2气体的体积为2.24?L?
D.35Cl2气体的摩尔质量为70?g?mol-1
参考答案:D
本题解析:分析:A.原子的质子数等于元素的原子序数;
B.根据中子数=质量数-质子数计算;
C.气体的条件未知,不能确定体积大小;
D.摩尔质量在数值上等于分子的相对分子质量,单位为g?mol-1.
解答:A.氯的原子序数为17,原子的质子数等于元素的原子序数,则35Cl原子所含质子数为17,故A错误;
B.35Cl原子所含中子数为35-17=18,1H原子的中子数为0,则1mol的1H35Cl分子所含中子数约为18×6.02×1023,故B错误;
C.气体的条件未知,不能确定体积大小,故C错误;
D.35Cl2气体的相对分子质量为70,则35Cl2气体的摩尔质量为70g?mol-1,故D正确;
故选D.
点评:本题考查物质的量的相关计算以及质量数、中子数和质子数之间的关系,题目难度不大,注意气体的存在条件是否标准状况下.
本题难度:困难
2、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.17g羟基中所含电子数为10NA
B.标准状况下,2.24?LCHCl3含有的分子数为0.1NA
C.1molNa与足量O2反应,生成Na2O和Na2O2的混合物,Na失去的电子数为NA
D.100g质量分数为98%的浓硫酸中含氧原子数为4NA
参考答案:C
本题解析:分析:A、依据n=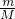 计算物质的量,结合羟基结构计算羟基电子数;
计算物质的量,结合羟基结构计算羟基电子数;
B、标准状况下,CHCl3不是气体;
C、钠全部反应失去电子依据反应的钠计算;
D、依据溶质质量=溶液质量×溶质质量分数,结合溶质中氧原子数计算;
解答:A、17g羟基物质的量为1mol,所含电子数为9NA,故A错误;
B、标准状况下,CHCl3不是气体,2.24 LCHCl3含物质的量不是0.1mol,故B错误;
C、1molNa与足量O2反应,钠全部反应失去电子依据反应的钠计算,生成Na2O和Na2O2的混合物,Na失去的电子数为NA,故C正确;
D、100 g质量分数为98%的浓硫酸中溶质质量为98g,溶质硫酸物质的量为1mol,溶液中含氧原子数大于4NA,故D错误
故选C.
点评:本题考查了阿伏伽德罗常数的应用,主要是质量换算物质的量计算微粒数,气体摩尔体积的条件应用,物质构成分析,题目难度中等.
本题难度:一般
3、选择题 将1L0.2mol/L?NaCl溶液和1L0.2mL/L?Na2SO4溶液混合,若溶液的体积为二者体积之和,则混合溶液中钠离子浓度为
A.0.2mol/L
B.0.3mol/L
C.0.6mol/L
D.0.8mol/L
参考答案:B
本题解析:分析:0.2mol/L?NaCl溶液中钠离子浓度为0.2mol/L,0.2mL/L?Na2SO4溶液中钠离子浓度为0.4mol/L,根据n=cV计算钠离子的物质的量,混合后溶液中的钠离子的物质的量等于氯化钠溶液与硫酸钠溶液含有的钠离子之和,再根据c=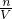 计算.
计算.
解答:解0.2mol/L?NaCl溶液中钠离子浓度为0.2mol/L,1L氯化钠溶液中钠离子的物质的量为1L×0.2mol/L=0.2mol,
0.2mL/L?Na2SO4溶液中钠离子浓度为0.4mol/L,1L硫酸钠溶液中钠离子的物质的量为1L×0.4mol/L=0.4mol,
混合后溶液中的钠离子物质的量为0.2mol+0.4mol=0.6mol,
故混合溶液中钠离子浓度为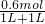 =0.3mol/L
=0.3mol/L
故选B.
点评:本题考查物质的量浓度的有关计算,比较基础,注意公式的理解与灵活运用.
本题难度:简单
4、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
A.1molO2参加反应,一定得4×6.02×1023个电子
B.7.5g?SiO2晶体中含有硅氧键数为0.5×6.02×1023
C.2.24L?CH4中含有的原子数为0.5×6.02×1023
D.250mL?2mol/L的氨水中含有NH3?H2O的分子数为0.5×6.02×1023
参考答案:B
本题解析:分析:A.有氧气参加的反应,不一定得4×6.02×1023个电子;
B.7.5g二氧化硅的物质的量=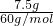 =0.125mol,一个硅原子含有4个硅氧键;
=0.125mol,一个硅原子含有4个硅氧键;
C.气体摩尔体积与温度和压强有关,标况下,气体摩尔体积是22.4L/mol;
D.一水合氨是弱电解质,在水溶液里存在部分电离.
解答:A.O2+2Na Na2O2,该反应中1molO2参加反应,得2×6.02×1023个电子,故A错误;
Na2O2,该反应中1molO2参加反应,得2×6.02×1023个电子,故A错误;
B.7.5g二氧化硅的物质的量=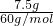 =0.125mol,一个硅原子含有4个硅氧键,所以7.5g?SiO2晶体中含有硅氧键数为0.125mol×4×6.02×1023/mol=0.5×6.02×1023,故B正确;
=0.125mol,一个硅原子含有4个硅氧键,所以7.5g?SiO2晶体中含有硅氧键数为0.125mol×4×6.02×1023/mol=0.5×6.02×1023,故B正确;
C.温度和压强未知导致气体摩尔体积未知,所以无法计算甲烷的物质的量,从而无法得出甲烷中原子个数,故C错误;
D.一水合氨是弱电解质,在水溶液里存在部分电离,所以250mL?2mol/L的氨水中含有NH3?H2O的分子数小于0.5×6.02×1023,故D错误;
故选B.
点评:本题以阿伏伽德罗常数为载体考查氧化还原反应、未知结构、弱电解质等知识点,易错点是B,明确二氧化硅结构特点是解B选项关键,为易错点.
本题难度:简单
5、选择题 实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19g?cm3,则物质的量浓度是
A.11.9
B.11.9mol?L-1
C.0.012mol?L-1
D.无法计算
参考答案:B
本题解析:分析:根据c= 计算该浓盐酸的物质的量浓度.
计算该浓盐酸的物质的量浓度.
解答:盐酸的溶质质量分数为36.5%,密度为1.19g?cm3,
则该浓盐酸的物质的量浓度为 mol/L=11.9mol/L.
mol/L=11.9mol/L.
故选:B.
点评:考查物质的量浓度与溶液质量分数的关系,难度中等,可以根据定义法计算,求出溶液的体积是关键.
本题难度:简单