1、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,0.1molC8H18所含有的共价键数目为2.0?NA
B.室温下,21.0?g乙烯与丙烯的混合气体中含有的碳原子数为1.5?NA
C.标准状况下,2.24L乙酸乙酯中所含氧原子数为0.2NA
D.0.1mol乙醇与氧化铜完全反应时转移电子数为0.1NA
参考答案:B
本题解析:分析:A、依据烷烃分子结构计算化学键数目;
B、乙烯与丙烯最简式为CH2,只需计算21gCH2中碳原子数即可;
C、乙酸乙酯是液体;
D、依据乙醇和氧化铜反应的化学方程式分析计算.
解答:A、常温常压下,0.1molC8H18所含有的共价键数目=0.1mol×(8-1+18)×NA=2.5 NA,故A错误;
B、乙烯与丙烯最简式为CH2,只需计算21gCH2中碳原子数=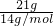 ×NA=1.5NA,故B正确;
×NA=1.5NA,故B正确;
C、标准状况下乙酸乙酯为液体,无法计算,故C错误;
D、乙醇和氧化铜反应生成铜、乙醛和水,CH3CH2OH+CuO=Cu+H2O+CH3CHO,反应过程中1mol乙醇反应电子转移2mol,0.1mol乙醇与氧化铜完全反应时转移电子数为0.2NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查烷烃分子结构,烯烃结构特征,气体摩尔体积的条件应用,氧化还原反应的电子转移,题目难度中等.
本题难度:一般
2、选择题 用NA表示阿伏加德罗常数的值,下列说法正确的是
A.100mL1mol?L-1的Na2S溶液中离子总数为0.3NA
B.2.3gNa在空气中完全燃烧失去0.1NA个电子
C.1mol?C2H4分子中共用电子对数目为5NA
D.标准状况下,44.8?L?CCl4中含2NA个分子
参考答案:B
本题解析:分析:A.根据反应S2-+H2O HS-+OH-判断;
HS-+OH-判断;
B.根据2.3gNa的物质的量和最外层电子数判断;
C.根据乙烯的结构简式CH2=CH2判断;
D.标准状况下CCl4为液体.
解答:A.有反应S2-+H2O HS-+OH-可知,100mL1mol?L-1的Na2S溶液中离子总数大于0.3NA,故A错误;
HS-+OH-可知,100mL1mol?L-1的Na2S溶液中离子总数大于0.3NA,故A错误;
B.2.3gNa为0.1mol,根据Na~Na+~e-可知,2.3gNa在空气中完全燃烧失去0.1NA个电子,故B正确;
C.由乙烯的结构简式CH2=CH2可知,C和4个H形成4个共价键,有4个共用电子对,并且C=C键有2个共用电子对,共有6个共用电子对,故C错误;
D.标准状况下CCl4为液体,Vm≠22.4L/mol,故D错误.
故选B.
点评:本题考查阿伏加德罗常数,题目难度不大,易错点为A,注意物质的性质.
本题难度:困难
3、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2L水中含有分子的数目为0.5NA
B.100mL0.2mol?L-1的FeCl3溶液中,含Fe3+数为0.02NA
C.1mol?Cl2与足量的NaOH溶液反应,转移的电子数为1NA
D.在密闭容器中加入0.5molN2和l.5mol?H2,充分反应后可得到NH3分子数为NA
参考答案:C
本题解析:分析:A、标准状况下,水不是气体;
B、三价铁离子水溶液中发生水解;
C、氯气和氢氧化钠的反应是氯气自身氧化还原反应,化合价从0价变化为-1价和+1价;
D、氮气和氢气合成氨是可逆反应不能进行彻底;
解答:A、标准状况下,11.2L水物质的量不是0.5mol,故A错误;
B、100mL0.2mol?L-1的FeCl3溶液中含三价铁离子物质的量为0.02mol,但铁离子水溶液中发生水解,所以溶液中含Fe3+数小于0.02NA,故B错误;
C、1mol Cl2与足量的NaOH溶液反应,氯气和氢氧化钠的反应是氯气自身氧化还原反应,化合价从0价变化为-1价和+1价,转移的电子数为1NA,故C正确;
D、在密闭容器中加入0.5molN2和l.5mol H2,反应是可逆反应不能进行彻底;充分反应后可得到NH3分子数小于NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,盐类水解的特征,氧化还原反应的电子转移数目计算,可逆反应的应用,题目较简单,D选项是易错点.
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.在0℃,压强为101×105Pa时,22.4L?Cl2与HCl的混合气体中含有的氯原子总数为3NA
B.0.5molI-被氧化时失去的电子数为0.5NA
C.0.1L3?mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023
D.常温常压下,48gO3含有氧原子数为3NA
参考答案:D
本题解析:分析:A、在0℃,压强为101×105Pa时是标准状况,体积换算物质的量结合分子式计算;
B、依据碘离子可以被氧化为碘单质或碘酸根;
C、铵根离子水解;
D、质量换算物质的量结合分子式计算氧原子数;
解答:A、标准状况下,22.4L Cl2与HCl的混合气体物质的量为1mol,含氯原子在1mol-2mol间,故A错误;
B、碘离子可以被氧化为碘单质或碘酸根,所以氧化产物不定,故B错误;
C、铵根离子水解,0.1L3 mol?L-1的NH4NO3溶液中含有的NH4+数目小于0.3×6.02×1023;故C错误;
D、48gO3物质的量为1mol,含有氧原子数为3NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,氧化还原反应的产物判断,盐类水解的应用.
本题难度:一般
5、选择题 下列气体中,摩尔质量最大的是
A.H2
B.O2
C.CO
D.NH3
参考答案:B
本题解析:分析:根据摩尔质量在以克/摩尔为单位时,在数值上等于该物质的相对分子质量,相对分子质量越大,物质的摩尔质量越大.
解答:H2、O2、CO、NH3的相对分子质量分别为:2、32、28、17,所以相对分子质量最大的是氧气,则摩尔质量最大的是氧气,故选:B;
点评:本题主要考查了摩尔质量,需要注意的是摩尔质量在以克/摩尔为单位时,在数值上等于该物质的相对分子质量.
本题难度:困难