1、选择题 下列有关物质的性质和该性质的应用均正确的是
A.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.常温下浓硫酸能与铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸
D.二氧化氯具有还原性,可用于自来水的杀菌消毒
参考答案:C
本题解析:A、铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块形成原电池铁作负极,加快其腐蚀,错误;B、二氧化硅能与氢氟酸反应,错误;C、常温下浓硫酸能与铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸,正确;D、二氧化氯用于自来水的杀菌消毒是利用其氧化性,错误。
本题难度:一般
2、实验题 二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。

(1)写出圆底烧瓶中反应的化学方程式?。
(2)A中m管的作用是?;装置F的作用是?。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是??,C中应盛放的试剂是? ?。
?。
(4)E中若装有FeCl2溶液,反应的离子方程式为?;E中若装有淀粉碘化钾溶液,能观察到的实验现象是?。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
 ? b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
? b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是?;实验c的目的是?。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是?。
参考答案:(1)MnO2+4HCl=MnCl2+Cl2↑+2H2O?(2分)
(2)平衡气压,使分液漏斗中的液体顺利下滴(2分);
防止G中液体倒吸至E中(2分)
(3)饱和食盐水(饱和NaCl溶液) (2分) ,?浓硫酸(2分)
(4)2Fe2++Cl2=2Fe3++2Cl-?(2分);?无色溶液显蓝色(2分)
(5)①探究Cl-浓度的影响(1分);?探究H+浓度的影响(1分)
②H+浓度的大小(1分)
本题解析:略
本题难度:一般
3、选择题 下列对氯气的说法不正确的是( )
A.氯气是由舍勒发现的
B.干燥的氯气不能使有色布条褪色
C.氯气不能支持燃烧
D.用氯气消毒自来水不如用臭氧消毒自来水好
参考答案:A. 1774年,瑞典化学家舍勒用二氧化锰和浓盐酸反应制得氯气,故A正确;
B.氯气不具有漂白性,则氯气不能使干燥有色布条褪色,故B正确;
C.任何发光,发热的剧烈的氧化反应叫燃烧,氢气和氯气发生H2+Cl2点燃.2HCl,所以氯气可以支持氢气燃烧,故C错误;
D.氯气与水反应Cl2+H2O?HCl+HClO,氯水中含有H+、Cl2、HClO、ClO-、Cl-等微粒,具有强氯化性的HClO、ClO-,可以杀死细菌、病毒,同时引入副产物H+、Cl2、Cl-,臭氧用作水消毒时,不存在二次污染问题,还兼有脱色、除味等功效,用氯气消毒自来水不如用臭氧消毒自来水好,故D正确;
故选C.
本题解析:
本题难度:一般
4、选择题 将过量的氯气通入30mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3的共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.15 mol
B.当反应中被氧化的氯元素和被还原的氯元素之比为1:4时,溶液中NaClO和NaClO3的物质的量之比为3:1
C.溶液中n(Na+):n(Cl-)可能为7:3
D.若Cl2与NaOH的反应中转移的电子为n mol,则0.15<n<0.35
参考答案:A
本题解析:A、根据题意知,过量的氯气通入30mL浓度为10.0mol/L的氢氧化钠浓溶液中,氢氧化钠完全反应,根据元素守恒知,2n(Cl2)=n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,n(Cl2)=0.15mol,正确;B、根据电子守恒知,当反应中被氧化的氯元素和被还原的氯元素之比为1:4时,溶液中NaClO和NaClO3的物质的量之比为1:3,错误;C、根据Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl-)最小为6:5,溶液中n(Na+):n(Cl-)不可能为7:3,错误;D、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,为0.15mol,氧化产物只有NaClO3,转移电子数最多,为0.25mol,错误。
本题难度:一般
5、选择题 将一定量的 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中
通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中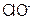 和
和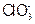 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
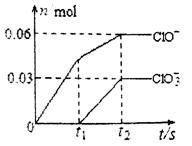
A.苛性钾溶液中KOH的质量是4.94g
B.反应中转移电子的物质的量是0.21mol
C.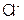 的物质的量为0.09mol
的物质的量为0.09mol
D.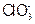 的生成是由于KOH过量引起的
的生成是由于KOH过量引起的
参考答案:B
本题解析:略
本题难度:一般