1、选择题 向某晶体的溶液中加入Fe2+的溶液无明显变化,当滴加几滴氯水后,混合液出现血红色,由此得出的下列结论错误的是( )
A.Fe3+的氧化性比氯的氧化性强
B.该晶体中一定含有SCN-
C.Fe2+不能与SCN-形成血红色化合物
D.Fe2+被氯氧化成Fe3+
参考答案:A、二价铁能被氯气氧化为正三价,氯气是氧化剂,三价铁是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,即Fe3+的氧化性比Cl2的氧化性弱,故A错误;
B、只有三价铁遇SCN-才能形成红色的化合物,所以晶体中一定含有SCN-,故B正确;
C、只有三价铁遇SCN-能形成红色的化合物,Fe2+与SCN-不能,故C正确.
D、氯气具有氧化性,Fe2+被Cl2氧化为Fe3+,故D正确;
故选A.
本题解析:
本题难度:一般
2、选择题 下列各组气体可用同一发生装置制取的是
A.Cl2和O2
B.H2和O2
C.H2和CO2
D.Cl2和HCl
参考答案:CD
本题解析:Cl2、HCl符合固+液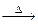 气体模式,H2和CO2符合固+液
气体模式,H2和CO2符合固+液 ↑,O2为固
↑,O2为固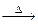 ↑,所以C、D项正确.
↑,所以C、D项正确.
本题难度:简单
3、选择题 使0.15mol MnO2与过量的12mol·L-1的浓盐酸反应,使50mL 12mol·L-1的浓盐酸与足量MnO2反应,两者产生的氯气相比(其他条件相同)
A.一样多
B.前者较后者多
C.后者较前者多
D.无法比较
参考答案:B
本题解析:MnO2与浓盐酸反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若浓盐酸过量,产生的氯气按照MnO2来计算。n(Cl2)=n(MnO2)= 0.15mol;若足量MnO2,发生应该以参加反应的HCl为标准。n(HCl)=0.05L×12mol/L=0.6mol。若HCl完全反应,放出的氯气的物质的量为HCl的1/4,即是0.15mol.但是只有浓盐酸才发生上述反应。随着反应的进行,盐酸变稀,这时反应不再进行,因此放出的氯气的物质的量小于0.15mol.。故前者较后者多。选项为B。
MnCl2+Cl2↑+2H2O。若浓盐酸过量,产生的氯气按照MnO2来计算。n(Cl2)=n(MnO2)= 0.15mol;若足量MnO2,发生应该以参加反应的HCl为标准。n(HCl)=0.05L×12mol/L=0.6mol。若HCl完全反应,放出的氯气的物质的量为HCl的1/4,即是0.15mol.但是只有浓盐酸才发生上述反应。随着反应的进行,盐酸变稀,这时反应不再进行,因此放出的氯气的物质的量小于0.15mol.。故前者较后者多。选项为B。
本题难度:一般
4、填空题 (8分)新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,为检验其成分,某研究性学习小组做了如下实验,请根据所做实验,按要求填空。
(1)取少量新制氯水于试管中,加入碳酸钙粉末,发现有气泡产生,则说明起作用
的成分是HCl,HCl表现出?性。
(2)取少量新制氯水于试管中,加入AgNO3溶液,发现有白色沉淀产生,则起作用的是?。
(3)取少量新制氯水于试管中,加入一块红纸,发现很快褪色,则起作用的是?。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有?性。
参考答案:(1)酸性?(2)Cl-?(3)? HClO?(4)强氧化
本题解析:略
本题难度:简单
5、填空题 用新制的氯水进行下列实验,将可能发生的现象以及对现象的解释或离子方程式填入下表。
?
| 实验现象
| 解释或离子方程式
|
滴入AgNO3溶液
| ?
| ?
|
滴在蓝色石蕊试纸上
| ?
| ?
|
滴入红墨水
| ?
| ?
参考答案:
?
实验现象
解释或离子方程式
滴入AgNO3溶液
有白色沉淀产生
Ag++Cl-==AgCl↓
滴在蓝色石蕊试纸上
先变红,后褪色
盐酸使石蕊变红,次氯酸有强氧化性,使石蕊褪色
滴入红墨水
红色褪去
次氯酸有漂白作用
本题解析:氯水中存在反应:Cl2+H2O H++Cl-+HClO,其中次氯酸具有强氧化性、弱酸性及漂白性; H++Cl-+HClO,其中次氯酸具有强氧化性、弱酸性及漂白性;
故滴入AgNO3溶液,发生反应:Ag++Cl-=AgCl↓,有白色沉淀生成
滴在蓝色石蕊试纸上,氯水呈酸性,使石蕊迅速变红,而次氯酸有强氧化性,石蕊随后褪色
滴入红墨水,由于次氯酸有漂白作用,红色褪去
本题难度:简单
|