1、选择题 1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2?1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
参考答案:C
本题解析:本题考查有关合金的化学计算,意在考查考生的化学计算能力。设合金中Cu、Mg的物质的量分别为x、y,根据题目所给信息知x×64 g/mol+y×24 g/mol=1.52 g ①;设金属为M,在反应过程中有:M-ne-===Mn+,Mn++OH-===M(OH)n↓,从而可以看出,金属单质失去电子的物质的量等于金属阳离子完全沉淀所需OH-的物质的量,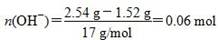 ,故2x+2y=0.06 mol ②,由①②解得x=0.02 mol,y=0.01 mol,显然A正确。
,故2x+2y=0.06 mol ②,由①②解得x=0.02 mol,y=0.01 mol,显然A正确。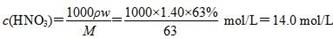 ,B正确。得到2.54 g沉淀时,消耗0.06 mol NaOH,其体积为60 mL,C错误。由上述分析可知,Cu、Mg共失去0.06 mol电子,根据得失电子守恒知,如果硝酸完全被还原为NO2,NO2的物质的量应为0.06 mol。现得到0.05 mol混合气体,是由于2NO2?N2O4,由差量法可求得N2O4为0.01 mol,则NO2为0.04 mol,显然D正确。
,B正确。得到2.54 g沉淀时,消耗0.06 mol NaOH,其体积为60 mL,C错误。由上述分析可知,Cu、Mg共失去0.06 mol电子,根据得失电子守恒知,如果硝酸完全被还原为NO2,NO2的物质的量应为0.06 mol。现得到0.05 mol混合气体,是由于2NO2?N2O4,由差量法可求得N2O4为0.01 mol,则NO2为0.04 mol,显然D正确。
本题难度:一般
2、选择题 氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(末配平)如下:Na3N+H2O →NaOH +NH3,CaH2+H2O →Ca(OH)2 +H2。有关它们的叙述:①离子半径:Na+>N3->H+;②与水反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
A.②③④⑤
B.①③⑤
C.②④
D.③
参考答案:D
本题解析:略
本题难度:简单
3、选择题 现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是
A.+4
B.+3
C.+2
D.+1
参考答案:A
本题解析:根据氧化还原反应中得失电子守恒计算。根据题意知,该反应中SO32-为还原剂,SO32-被氧化,为SO42-,化合价从+4升到+6价失电子数=0.1mol/L×0.03L×2=0.006mol,XO4-为氧化剂,X元素化合价降低,设元素X在还原产物中的化合价为n,根据得失电子守恒得2×10-3 mol(7—n)=0.006mol,解得n=4,选A。
本题难度:一般
4、选择题 PbO2受热分解为+4和+2价的Pb的混合氧化物, +4价的Pb能氧化浓盐酸生成Cl2 ,现将1molPbO2加热分解得到O2 ,再向残余固体中加入过量的浓盐酸得到Cl2 , O2和Cl2物质的量之比为3:2,则残余固体的组成及物质的量之比可能是
A.2:1混合的Pb3O4、PbO
B.1:4:1混合的PbO2、Pb3O4、PbO
C.1:2混合的PbO2、Pb3O4
D.1:1:4混合的PbO2、Pb3O4、PbO
参考答案:D
本题解析:PbO2受热分解得到氧气和铅的氧化物的混合物(Pb为+4、+2价),铅的氧化物的混合物再与盐酸作用时,+4价Pb还原为+2价,Cl-被氧化为Cl2,此时得到溶液为PbCl2溶液,利用“电荷守恒”知1molPbO2在上述转化过程中共转移2mole-。设该过程得到O2的物质的量为3xmol,则Cl2的物质的量为2xmol,利用电荷守恒可得:3x×4+2x×2=2,解得x=0.125,故知1mol PbO2在受热分解过程中产生0.375molO2,利用原子守恒可知受热后的剩余固体中n(Pb):n(O)=4:5,结合选项可知只有D项满足n(Pb):n(O)=4:5,故答案为D。
本题难度:一般
5、选择题 已知氧化性Fe3+>I2。向Fe I 2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b I-+c Cl2→d Fe3++ e I2+ f Cl- 。下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
A.2,4,3,2,2,6
B.0,2,1,0,1,2
C.2,0,1,2,0,2
D.2,8,5,2,4,10
参考答案:C
本题解析:A、氯气过量,I-、Fe2+都完全被氧化,反应方程式为2 Fe2++4 I-+3 Cl2→2 Fe3++2 I2+ 6 Cl-,正确;B、加入的氯气的物质的量与I-的物质的量1:2时,发生反应2 I-+ Cl2→ I2+ 2 Cl-,正确;C、氧化性Fe3+>I2,不可能存在Fe3+、I-共存,错误;D、当加入的氯气把I-完全氧化成I2,还有部分剩余时,可以发生反应,2 Fe2++8 I-+5 Cl2→2 Fe3++ 4 I2+ 10 Cl-正确。
本题难度:一般