1、选择题 某食品袋中有一个写着“干燥剂”的小纸袋,里面的主要成分是生石灰,对此“干燥剂”的说法正确的是?(?)。
A.此干燥剂为混合物
B.小纸袋中的物质可长期持续地做干燥剂
C.其中钙元素的存在形态为游离态
D.此干燥剂可以食用
参考答案:A
本题解析:
本题难度:一般
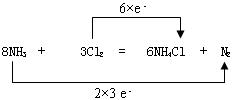
2、填空题 (10分)根据反应8NH3+3Cl2=6NH4Cl+N2回答下列问题。
(1)氧化剂?,还原剂?
(2)用双线桥法标出反应中电子转移情况?
(3)氧化剂与氧化产物的质量比__________
(4)当生成28gN2时,被氧化的物质的质量是__________g。?
参考答案:(10分)(1)Cl2,NH3
(2)
(3)___213_∶_28_____?(4)___34____g。
本题解析:略
本题难度:一般
3、计算题 (1小题1分,2、3小题各2分,共5分)用15.8 g KMnO4与12mol/L的浓HCl发生。反应方程式如下:2KMnO4+ 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O?通过计算解答以下问题:
g KMnO4与12mol/L的浓HCl发生。反应方程式如下:2KMnO4+ 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O?通过计算解答以下问题:
(1)KMnO4能使多少毫升浓HCl发生上述反应?
(2)被氧化的HCl的物质的量为多少?
(3)产生的Cl2在标准状况下的体积为多少?电子转移总数为多少?
参考答案:(5分)(1)66.7 mL(1分)?(2)0.5mol (2分)?(3)5.6L? 0.5mol(2分)
本题解析:略
本题难度:简单
4、选择题 在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为……(?)
A.3.0mol
B.1.5mol
C.1.0mol
D.0.75mol
参考答案:B
本题解析:利用电子守恒,当1molCr3+被氧化为Cr2O72-(0.5mol)时,所失去的电子为3mol,这些电子被PbO2得到,而1molPbO2被还原只能得到2mol电子,因此所需PbO2的物质的量为1.5mol.
本题难度:一般
5、填空题 (6分)配平并完成下面离子方程式:
HCl + KClO3= Cl2 + KCl+ [ ]
参考答案:6;1;3;1;3 ;H2O 每空1分
本题解析:考查氧化还原反应方程式的配平。在氧化还原反应中电子的得失必须是守恒的,据此进行配平。在反应中HCl中氯元素的化合价由-1价升高到0价,变化1个单位。氯酸钾中氯元素的化合价由+5价降低到0价,变化5个单位。属于还原剂和氧化剂的物质的量之比是5
本题难度:一般