1、选择题 某化学兴趣小组同学探索某些溶液的酸碱性。25℃时他们分别测得CH3COOH和(NH4)2SO4?两种溶液的pH都为4,并对结果作了以下四种分析。则其中正确的是
A.(NH4)2SO4?溶液呈酸性,是因为NH4+电离出H+
B.因为醋酸是弱酸,所以醋酸溶液中水的电离平衡被促进了
C.CH3COOH和(NH4)2SO4?溶液中水的电离出来的H+的物质的量浓度相同
D.CH3COOH和(NH4)2SO4?两水溶液呈酸性的原因不同
2、选择题 将标准状况下的2.24 L CO2通入150 mL 1mol / LNaOH溶液中,下列说法正确的是
A.c(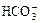 )略大于c(
)略大于c( )
)
B.该溶液只能与酸反应,不能与碱反应
C.c(Na+)等于c( )与c(
)与c(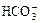 )之和
)之和
D.c(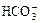 )略小于c(
)略小于c( )
)
3、选择题 25℃时,下列关于分别由等体积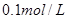 的2种溶液混合而成的溶液(忽略溶液体积
的2种溶液混合而成的溶液(忽略溶液体积 的变化)的说法中不正确的是
的变化)的说法中不正确的是
A.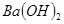 溶液与
溶液与 溶液:
溶液: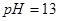
B.醋酸与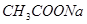 溶液:
溶液:
C.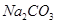 溶液与
溶液与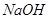 溶液:
溶液: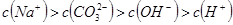
D.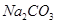 溶液与
溶液与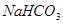 溶液:
溶液:
4、选择题 将0.1mol/LNaOH和0.1mol/LNH4CI溶液等体积混合后,离子浓度大小正确的次序是:
A? C(Na+)>C(CI-)>C(OH-)>C(H+)?
B、C(Na+)=C(CI-)>C(OH-)>C(H+)
C、C(Na+)=C(CI-)>C(H+)>C(OH-)
D、C(CI-)>C(Na+)>C(OH-)>C(H+)
5、选择题 下列叙述正确的是( )
A.浓度均为0.1 mol·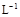 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:
的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:
c(CH3COOH)+c(CH3COO-)="0.2" mol·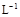
B.0.1 mol·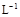 NaHCO3溶液中:c(Na+)=c(HC
NaHCO3溶液中:c(Na+)=c(HC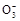 )+c(H2CO3)+2c(C
)+c(H2CO3)+2c(C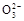 )
)
C.0.2 mol·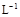 HCl溶液与等体积的0.1 mol·
HCl溶液与等体积的0.1 mol·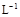 NaOH溶液混合后,溶液的pH=1
NaOH溶液混合后,溶液的pH=1
D.0.1 mol·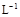 氨水中滴入0.1 mol·
氨水中滴入0.1 mol·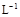 盐酸至溶液呈中性时,混合溶液中:c(N
盐酸至溶液呈中性时,混合溶液中:c(N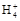 )=c(Cl-)
)=c(Cl-)