1、选择题 下列比较不正确的是(?)
A.稳定性:HF > HCl > HBr > HI
B.碱性:NaOH > Mg(OH)2 > Al(OH)3
C.酸性:H2SO4 > H3PO4 > HClO4
D.氧化性:O2 > S > Se
参考答案:C
本题解析:略
本题难度:简单
2、选择题 下列各组微粒半径(R)之比大于1的是?
A.R(Mg)/R(Na)
B.R(P)/R(Cl)
C.R(Al3+)/R(Na+)
D.R(K)/R(Br)
参考答案:B、D
本题解析:同周期元素(主族),从左到右随着核电荷递增,原子半径、阳离子半径或阴离子半径都依次减小。钠和镁都位于元素周期表第3周期,钠在镁的左边,钠原子半径大于镁原子,R(Mg)/R(Na)小于1,A错。磷和氯都位于第3周期,磷在氯左边,磷的原子半径大于氯,R(P)/R(Cl)大于1,B对。钠和铝都失去外层电子成为阳离子,都具有两个电子层,铝的核电荷数大于钠。铝对核外电子吸引力大,铝离子的半径小于钠离子,它们的半径比值小于1,C错。钾和溴都位于第4周期,都是主族元素,钾的原子半径大于溴,两原子半径比大于1,D对。
本题难度:一般
3、选择题 短周期元素x和y可以相互形成化合物x2y,那么x和y所在族的族数之差可能是
A.1
B.3
C.4
D.5
参考答案:AD
本题解析:略
本题难度:简单
4、填空题 下表为元素周期表的一部分,请参照元素A-H在表中的位置,
族
 周期 周期
| IA
| ?
| 0
|
1
| A
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| B
| C
| D
| ?
| ?
|
3
| E
| ?
| F
| G
| ?
| ?
| H
| ?
|
用化学用语回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。
(2)B、C、D的第一电离能由大到小的顺序为_________________________。
 (3)A、D、E、H中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)A、D、E、H中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
 (4) E、F的最高价氧化物的水化物相互反应的离子方程式?
(4) E、F的最高价氧化物的水化物相互反应的离子方程式? ?。
?。
(5)在B所形成的化合物CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ;
与CO分子互为等电子体的分子和离 子分别为? 和 ?,根据等电子理
子分别为? 和 ?,根据等电子理
论推测CO分子的结构式可表示成 ,一个CO分子中有 个σ键, 个л键。
(6)根据VSEPR理论预测D和H所形成的HD4— 离子的空间构型为______________型。
(7)由A、B、C、D、E元素组成的10电子粒子中,含配位键的有?、?;
参考答案:(1)Na﹥Al﹥O?
(2)N﹥O﹥C
 ?
?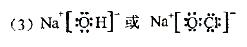
(4)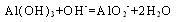
(5) CH4、CH3OH? N2? C22—?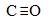 ?1? 2
?1? 2
(6)正四面体型
(7)NH4+? H3O+
本题解析:略
本题难度:简单
5、选择题 X、Y、Z是同周期的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>H2YO4>H3ZO4。则下列说法正确的是(?)
A.原子半径:X>Y>Z
B.元素的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z
D.原子序数:Z>Y>X
参考答案:B
本题解析:
正确答案:B
X、Y、Z是同周期的三种元素,在周期表中的位置是从右到左
A、不正确,同周期从左到右原子半径减小,原子半径:X<Y<Z;B、正确,元素的非金属性:同周期从左到右增强;C、不正确,同周期从左到右气态氢化物稳定性增强,X>Y>Z ,D、不正确,同周期从左到右原子序数递增:X>Y>Z
本题难度:一般