|
高中化学知识点总结《氧化性和还原性强弱的比较》练习题(四)
2019-06-25 23:45:47
【 大 中 小】
|
1、选择题 根据以下几个反应:
①Cl2+2KBr=2KCl+Br2 ②Br2+2KI=2KBr+I2 判断氧化性由强到弱的顺序是( )
A.I2>Br2>Cl2
B.Cl2>Br2>I2
C.Br2>I2>Cl2
D.Cl2>I2>Br2
|
参考答案:B
本题解析:根据氧化还原反应规律:氧化剂的氧化性大于氧化产物的氧化性。①中的氧化剂是氯气,氧化产物是溴单质,所以氧化性Cl2>Br2;②中的氧化剂是溴,氧化产物是碘,所以氧化性是Br2>I2,所以氧化性的顺序是Cl2>Br2>I2,答案选B。
考点:考查氧化还原反应规律的判断
本题难度:一般
2、选择题 多种氧化剂和多种还原剂共存时,存在“争先恐后,强者优先”现象。请理论预测,在含有Cu(NO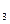 ?) ?)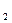 、Mg(NO 、Mg(NO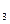 ) )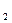 和AgNO 和AgNO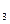 的溶液中加入适量锌粉,首先置换出来的是( ) 的溶液中加入适量锌粉,首先置换出来的是( )
A.Mg
B.Cu
C.Ag
D.H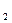
参考答案:C
本题解析:Zn在金属活动性顺序表中排在Mg的后面,不能与Mg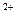 发生置换反应。Cu 发生置换反应。Cu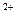 、Ag 、Ag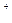 、H 、H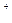 均能与Zn发生置换反应且氧化性Ag 均能与Zn发生置换反应且氧化性Ag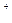 >Cu >Cu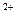 >H >H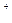 ,故在三者共存的情况下,氧化性最强的Ag ,故在三者共存的情况下,氧化性最强的Ag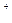 优先与Zn发生置换反应。答案为C。 优先与Zn发生置换反应。答案为C。
本题难度:一般
3、选择题 2011年3月18日至19日,受“吃碘盐能防止核辐射”等谣言的影响,我国部分地区出现抢购食盐现象。已知碘盐的主要成分是KIO3和NaCl,KIO3与NaHSO3发生反应:2KIO3 + 6NaHSO3 ="=" 2KI + 3Na2SO4 + 3H2SO4,下列说法中不正确的是
A 23Na37Cl中质子数和中子数之比是8:7 ?B.KIO3和NaCl都是强电解质
C.KIO3作氧化剂被还原?D.生成1mo1 KI时,转移6 mo1电子
参考答案:A
本题解析: A 23Na的质子数是11,中子数是12;而37Cl质子数是17,中子数是20.因此23Na37Cl中质子数和中子数之比是(11+17):(12+20)=7:8。错误。B.KIO3和NaCl都是盐。属于强电解质。正确。C.在该反应中KIO3中的I元素的原子获得电子变为-1价的I-,作氧化剂被还原。正确。D.在反应方程式中I的化合价变化了6价,所以每生成1mo1 KI时,转移6 mo1电子。正确。
本题难度:简单
4、填空题 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
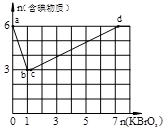
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3-+ Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
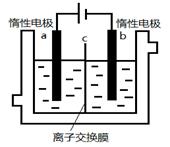
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。
参考答案:(1)1:6;KBr
(2)BrO3—+5Br—+6H+=3Br2+3H2O(2分);
(3)不正确,该反应I2作还原剂,Br2还原产物,应得出还原性I2>Br2(合理即可)(2分)
(4)7.2mol(2分);
(5)I—+6OH——6e—=IO3—+3H2O(2分)
本题解析:(1)由图像可知b点时含碘物质的物质的量最低,则证明KI反应完全生成I2,由图可知消耗的氧化剂与还原剂物质的量之比为1:6,还原产物KBr。
(2)b→c过程中含碘物质的物质的量不变,只有一种元素的化合价发生变化只能是Br元素变价,则该过程的离子反应方程式BrO3—+5Br—+6H+=3Br2+3H2O。
(3)在氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,由反应②得出氧化性:
BrO3- >IO3- ;还原性:I2>Br2;
(4)6 molKI的硫酸溶液中加入KBrO3发生的化学反应依次为:
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
BrO3—+5Br—+6H+=3Br2+3H2O。
②2BrO3- +I2 = 2IO3-+ Br2;
可知当I一完全被氧化为IO3-,BrO3-还原为Br2时消耗KBrO3最多为6×6mol/5=7.2mol。
(5)电解目的是制备KIO3,阳极发生氧化反应,则应为I-放电生成IO3—,电极反应式为:
I—+6OH——6e—=IO3—+3H2O。
考点:了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题利用图像题的形式考查氧化还原反应的规律及相关计算,熟练掌握氧化还原反应的规律(强弱律、电子守恒律等)的基础上还要注意数形结合,从图中找出重要数据解决问题。
本题难度:困难
5、选择题 根据下列事实,判断离子的氧化性顺序为 ( )
①A+B2+===A2+ +B ②D+ 2H2O===D(OH)2+ H2↑
③以B、E为电极与E的盐溶液组成原电池,电极反应为: E2++2e-===E,B-2e-===B2+
A. E2+ >B2+ >A2+ >D2+ B.D2+ >E2+ >A2+ >B2+
C.A2+ >B2+ >D2+ >E2+ D.D2+ >B2+ >A2+ >E2+
参考答案:A
本题解析:根据同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,则①A+B2+=A2++B中,氧化性B2+>A2+,②D+2H2O=D(OH)2+H2↑中,氧化性H+>D2+,③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+,氧化性E2+>B2+,所以这几种离子的氧化性大小顺序为:E2+>B2+>A2+>D2+,故选A。
考点:考查氧化性强弱比较
本题难度:一般
|