1、选择题 有四种无色溶液,它们分别是(NH4)2SO4、NH4Cl、Na2CO3、NaNO3,下列试剂中可以用来鉴别它们的是( )
A.BaCl2溶液
B.NaOH溶液
C.Ba(OH)2溶液
D.AgNO3溶液
参考答案:A.加入BaCl2溶液不能鉴别(NH4)2SO4和Na2CO3,故A错误;
B.加入NaOH溶液不能鉴别(NH4)2SO4、NH4Cl,故B错误;
C.加入Ba(OH)2溶液,(NH4)2SO4生成刺激性气体和白色沉淀,NH4Cl只生成刺激性气体,Na2CO3只生成白色沉淀,NaNO3无现象,可鉴别,故C正确;
D.加入AgNO3溶液,(NH4)2SO4、NH4Cl、Na2CO3都生成白色沉淀,不能鉴别,故D错误.
故选C.
本题解析:
本题难度:一般
2、填空题 某工业废液里含有FeCl2、CuCl2和FeCl3.为回收铜并得到纯净的FeCl3溶液,现设计如下综合利用的主要流程.
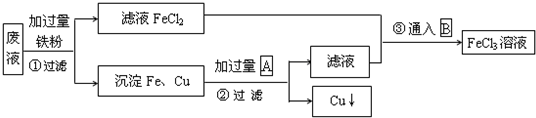
已知:A、B含同一种元素,试推断:
(1)方框内物质A和B的化学式:A______;B______.
(2)第③步通入B的化学方程式为______.
参考答案:(1)分离Cu和Fe,可加入盐酸,得到FeCl2和Cu,反应后的滤液为FeCl2,可与Cl2反应生成FeCl3,
故答案为:HCl;Cl2;
(2)第③步为氯化亚铁与氯气反应而转化为氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-.
本题解析:
本题难度:一般
3、实验题 在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”时,请设计一种简便的判断方法。
参考答案:取一支小试管,打开分液漏斗的活塞,慢慢放出下层的少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中的下层是水层,反之,则上层是水层。
本题解析:
本题难度:一般
4、实验题 (11分)某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器。
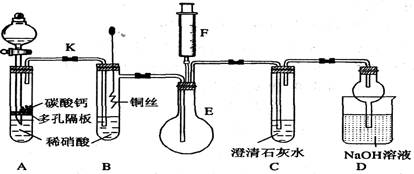
请回答有关问题:
(1) 设计装置A的目的是?;
为达到此目的,应进行的操作是打开K,且打开分液漏斗活塞,当装置C中产生?
?时,关闭K。
(2) 在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的
现象是?;
B中反应的离子方程式为:?。
(3) 装置E和F的作用是?;为实现此作用,其操作方法是?。
(4) 装置D的作用是吸收多余的氮氧化物,防止污染空气,兼有?的功能。
参考答案:(1)利用生成的二氧化碳将整个装置内的空气赶尽,避免NO和氧气反应生成二氧化氮对气体产物的观察产生干扰。?(2分)?白色沉淀(1分)
(2)铜丝表面产生气泡,稀硝酸液面上仍为无色,溶液变为蓝色(2分)
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(3)验证无色气体为NO;(1分)?将注射器F中的空气推入E中或将E中的无色气体吸入到注射器中。(2分)? (4)防止溶液倒流。(1分)
本题解析:(1)由于装置中含有空气,能把NO氧化生成NO2,从而干扰实验。所以需要利用生成的二氧化碳将整个装置内的空气赶尽,避免NO和氧气反应生成二氧化氮对气体产物的观察产生干扰。澄清的石灰水能吸收CO2,产生白色沉淀,据此可以判断。
(2)稀硝酸具有氧化性,能把铜氧化,生成硝酸铜、NO核水,所以现象就是铜丝表面产生气泡,稀硝酸液面上仍为无色,溶液变为蓝色。有关的方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(3)由于NO极易被氧化生成NO2,所以EF的作用是验证无色气体为NO的。具体的操作是将注射器F中的空气推入E中或将E中的无色气体吸入到注射器中。
(4)NO2极易溶于水,所以还有防止溶液倒流的作用。
本题难度:一般
5、实验题 固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。

(1)仪器B的名称是________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为________;Ⅳ中发生反应的化学方程式为________;V中的试剂为________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ?Ⅲ?Ⅳ?Ⅱ?V?Ⅵ,此时Ⅱ中现象为________,原因是________。
(4)经上述反应,2.5 g化合物A理论上可制得0.56 L(标准状况)M,则A的化学式为________。
参考答案:(1)分液漏斗 (2)碱石灰;3CuO+2NH3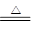 3Cu+N2+3H2O;浓H2SO4 (3)试纸变蓝;氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝
3Cu+N2+3H2O;浓H2SO4 (3)试纸变蓝;氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝
(4)Mg3N2
本题解析:(1)带有活塞的漏斗是分液漏斗。(2)根据实验流程图可知,用红色石蕊试纸检验的是氨气,氨气是一种碱性气体,用碱石灰干燥氨气;氨气具有还原性,可将黑色的CuO还原为红色的Cu,自身被氧化为N2;尾气中的氨气被浓硫酸吸收,最后N2用排水法收集。(3)氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝。
(4)0.56 L M即N2的物质的量为0.025 mol,则化合物A中N的质量为0.7 g,则另一种元素的质量为1.8 g,经过对A中未知元素的化合价讨论可得,只能是+2价的Mg,故该物质是Mg3N2。
本题难度:一般