1、推断题 (13分)硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成的。某校化学研究性学习小组用类比学习思想,并通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
【实验探究】取适量Na2S2O3晶体,溶于水制成Na2S2O3溶液,进行如表所示的探究,完成表中有关内容。
实验操作
| 实验现象
| 现象解释(用离子方程式表示)
|
探究①A.?
B.向pH=2的硫酸中滴加Na2S2O3溶液
| a.溶液pH=8
b.?
| i.?
ii. S2O32-+2H =S↓ +SO2↑ +H2O =S↓ +SO2↑ +H2O
|
探究②C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液
| c.氯水颜色变浅
| iii.?
|
【实验结论】探究①?探究②?。
根据探究①和探究②的结论,Na2S2O3和Na2SO4化学性质?。
【问题讨论】
(1)甲同学向探究②反应后的溶液中滴加AgNO3溶液,出现白色沉淀,据此甲同学认为氯水可将Na2S2O3氧化。你认为此方案是否正确并说明理由:?。
(2)请你重新设计一个实验方案,证明Na2S2O3能被氯水氧化。你设计的方案是?。
2、填空题 (1)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)现将溶液两两混合,记录现象如下:
A+B→白色沉淀B+D→白色沉淀C+D→蓝色沉淀
写出上述反应对应的离子方程式:
A+B→白色沉淀:______;
B+D→白色沉淀:______;
C+D→蓝色沉淀:______.
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性,写出发生反应的离子方程式:______.
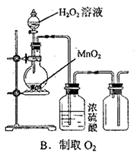
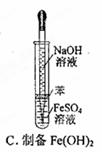
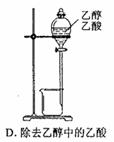
3、选择题 下图所示对试剂选用或实验操作正确的是
 ?
? ?
? ?
?
4、填空题 (2009江苏盐城调研,17)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的菱锰矿(MnCO3)(贫矿)转化为高品位“菱锰矿砂(MnCO3)”的绿色工艺。该工艺流程如下图所示:
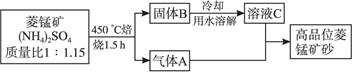
回答下列问题:
(1)气体A中含有两种气体,溶液C与气体A发生反应的化学方程式为________________。
(2)锰的化合物用途广泛,例如MnO2、KMnO4都是重要的锰化合物。MnO2可用于制备KMnO4,一般是先由MnO2在碱性条件下与O2反应制备得到K2MnO4,再由K2MnO4通过以下两种方式制备KMnO4。
方法一:电解法:2K2MnO4+2H2O 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑
方法二:CO2法:3K2MnO4+2CO2====2KMnO4+MnO2↓+2K2CO3
①写出MnO2得到K2MnO4的化学方程式:_______________________________。
②以上两种制备方法,方法一相对于方法二,所具有的优点是_______________________。
③KMnO4粉末在低温下与浓硫酸作用,可生成油状液体,它在0 ℃以下是稳定的,室温下会立即发生爆炸分解,分解产物为MnO2和O2,则该物质的化学式为_________________。
5、实验题 用如图所示装置进行实验,将A逐滴加入B中。
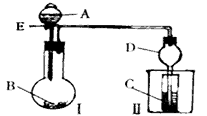
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到C中溶液褪色,则B是_______,然后往烧杯中加入沸水,又可观察到的现象是________。
(2)若B为Na2CO3,C为NaAlO2溶液,实验中观察到小试管内溶液变浑浊,则酸A的酸性比_______强,写出试管C中反应的离子方程式__________。
(3)若B是生石灰,实验中观察到C中溶液由无色变为红色,若在C中加入醋酸铵固体红色变浅,则A是__________,解释C中加入醋酸铵固体红色变浅的原因:__________(用方程式及必要的文字说明) 。