1、填空题 二氧化钛(TiO2)广泛用于制造高级白色油漆,也是许多反应的催化剂.工业上用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及绿矾,其生产流程如下:
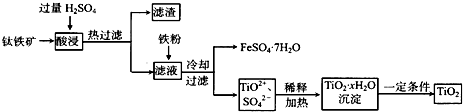
回答下列问题:
(1)Ti原子序数为22,则Ti位于周期表第______周期,第______列.
(2)FeTiO3溶于过量硫酸的离子方程式______.
(3)流程中生成TiO2?xH2O离子方程式为______.
(4)若铁粉的用量不足,可能导致产品TiO2中混有______杂质.
(5)以TiO2为原料制取金属钛的其中一步反应为TiO2+Cl2+C
TiCl4+______,已知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为______.
(6)TiCl4?在常温下呈液态,且极易水解,可以用作军事烟雾剂;写出其水解反应的方程式______.
2、简答题 某实验小组利用如下仪器组装一套制备氮化硼晶体的装置.
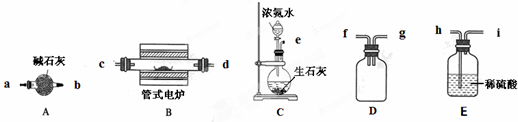
反应原理是B2O3+2NH3?
2BN+3H2O.(已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水.)
(1)各仪器接口由左到右的连接顺序为______.
(2)装置C能产生氨气的原因有______(答出其中一项即可).
(3)管式电炉加热反应前必须进行的一步操作是______.
3、实验题 某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是?。
第1组
| 第2组
| 第3组
|
S(单质)
| SO2、X、Na2SO3、NaHSO3
| SO3、H2SO4、Na2SO4、NaHSO4
|
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2?-76.1℃,SO3 ?16.8℃;沸点:SO2?-10℃,SO3?45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是?。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是?;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是?。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是?。
4、选择题 下列实验操作及现象能够达到对应实验目的的是
?
| 实验内容
| 实验目的
|
A
| 将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色
| 证明亚硫酸的不稳定性
|
B
| 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生
| 证明常温下KSP(BaSO4)>KSP(BaCO3)
|
C
| 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH
| 证明相同条件下,在水中HCl电离程度大于CH3COOH
|
D
| 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊
| 检验气体产物中CO2的存在
|
?
5、实验题 菠菜营养丰富,素有“蔬菜之王”的美称。民间流传:菠菜豆腐同食,易得结石。某化学兴趣小组对“菠菜豆腐是否能同食”等阃题进行了探究。
【查阅资料】①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。②人体结石的主要成分:草酸钙(CaC2O4) ③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。
【提出猜想】“菠菜豆腐不能同食”的原因可能是_____________________。
【探究一】菠菜中部分成分分析
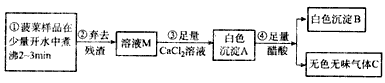
(1)步骤③中加入足量的CaCl2溶液的目的是________________________。
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式____________________,步骤②所需要的玻璃仪器是_______________________。
(3)白色沉淀B的化学式为________________________,由此可见菠菜豆腐不能同食。以下饮食观点正确的是__________(填字母)。
A.禁吃菠菜 B.高钙牛奶可与菠菜同食 C.菠菜烹饪前可用开水烫,可降低草酸盐含量
【探究二】某草酸钙晶体(CaC2O4·xH2O)热分解研究按下图示装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)。
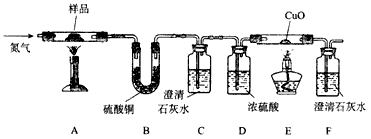
(4)①反应开始前通入氮气的目的是_______________。②装置B中硫酸铜粉末变蓝,说明产物中有________________,C、F 中澄清石灰水均变浑浊,E中CuO变红,说明产物还有_______________和____________,经检验A中残留固体为氧化物。③对上述装置从环保角度提一个改进建议___________________。
(5)某研究所利用SDTQ600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,获得相关数据,绘制成固体质量-分解温度的关系如下图。
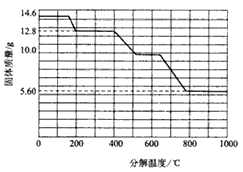
①800℃以上时,固体成分的化学式为____________;
②计算CaC2O4·xH2O中的x=_________________;
③残留固体为CaC2O4时的温度范围为________________;写出固体质量由12.8g变为10.0g时的化学方程式______________________。