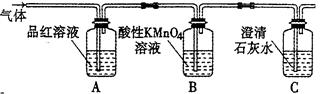
1、选择题 下列溶液中能够区别SO2和CO2气体的是
①澄清石灰水?②KMnO4酸性溶液?③氯水?④品红溶液
A.①③④
B.②③④
C.①②③
D.全部
参考答案:B
本题解析:①二者都能使澄清石灰水变浑浊,错误;②二氧化硫能使高锰酸钾褪色,而二氧化碳不行,正确;③二氧化硫能使溴水褪色,二氧化碳不行,正确;④二氧化硫能使品红褪色,二氧化碳不行,正确。
本题难度:一般
2、实验题 某校课外活动小组同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分。
【实验探究】
(1)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)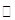 CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是?(填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是?g,标况下产生SO2的体积为______________L。
CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是?(填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是?g,标况下产生SO2的体积为______________L。
(2)A装置中品红溶液颜色?(填“褪色”或“不褪色”),证明含有?气体。
(3)实验过程中,装置C将观察到的现象是_______________________________。
【实验讨论】
(4)有同学对B装置能否除尽SO2气体有疑义。你认为应该在B、C装置之间连接右图中?装置,以确认SO2是否除尽。

【联系实际】
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是_________,二氧化碳造成的环境影响主要是_______。(每空格只填一个选项)
A.酸雨?B.破坏臭氧层? C.温室效应
参考答案:(14分)
(1)氧化剂(1分)? 39.2 (2分)? 8.96(2分)
(2)褪色(1分)? SO2(或二氧化硫)(2分)
(3)石灰水变浑浊(2分)
(4)a (2分)
(5)A? C (每空1分,共2分)
本题解析:(1)浓H2 SO4中硫化合价降低,作氧化剂,0.2mol碳的完全反应,则消耗H2S04的质量是0.4mol×98g/mol=39.2g;标况下产生SO2的体积为0.4mol×22.4L/mol=8.96?L,答案:氧化剂(1分)? 39.2 (2分)? 8.96(2分)
(2)A装置中品红溶液颜色褪色,说明有SO2中生成。答案:褪色(1分), SO2(或二氧化硫)(2分)
(3)B将SO2除去后,装置C将观察到的现象石灰水变浑浊,说明有CO2生成,答案:石灰水变浑浊(2分)
(4)应该在B、C装置之间连接a装置,用来证明SO2已经除尽,答案:a (2分)
(5)SO2主要是形成酸雨,CO2主要是形成温室效应,答案:A? C (每空1分,共2分)
本题难度:一般
3、实验题 (14分)某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
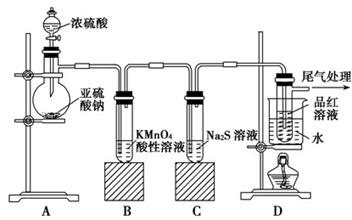
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________。
(2)实验过程中,装置B中产生的现象是________________________,这个现象说明SO2具有的性质是________________。
(3)装置C中Na2S溶液在空气中不易保存,时间长了会变浑浊,原因是(用离子方程式表示) __________________________________。
(4)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象__________________________________。
(5)如果把分液漏斗中的中的浓H2SO4换作浓HNO3,对此实验是否有影响
________(填“是”或“否” ),请说明你的理由_____________________________
(6)工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
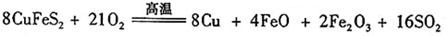
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是?(填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
参考答案:(1)蒸馏烧瓶(1分) (2)?溶液颜色由紫色逐渐退去 还原性(每空1分,计2分)
(3)? 2S2-+O2+2 H2O ===2 S↓+4 OH-(2分)
(4)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色(2分)
(5)是(1分)浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体(2分)
(6)?Cu 、O(2分)(只写一个不得分)?10NA或6.02×1024(2分)
本题解析:(1)根据仪器的构造可判断,该仪器是蒸馏烧瓶。
(2)A中产生SO2,由于SO2具有还原性,而酸性高锰酸钾溶液具有氧化性,所以B中溶液颜色由紫色逐渐退去。
(3)硫化钠中硫元素的化合价是最低价-2价,具有还原性,极易被氧化,生成单质硫,方程式为2S2-+O2+2 H2O ===2 S↓+4 OH-。
(4)SO2的漂白性原理是和有色物质结合,生成不稳定的无色物质。在加热的条件下,又能恢复原来的颜色,据此可以检验。即品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色。
(5)由于浓硝酸具有强氧化性,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体,因此对实验造成影响。
(6)CuFeS2中 Fe 的化合价为+2 ,则Cu的化合价是+2价,S的化合价是-2价。在生成物中Cu的化合价是0价,得到电子,被还原。同时氧气也是氧化剂,氧元素被还原;当生成0.8 mol铜时,被还原的铜是0.8mol,氧气是2.1mol,所以转移电子是0.8mol×2+2.1mol×4=10mol,即转移电子的个数是10NA或6.02×1024。
本题难度:一般
4、选择题 下列气体通入BaCl2溶液中,有白色沉淀生成的是
A.CO2
B.SO2
C.SO3
D.NH3
参考答案:C
本题解析:分析:二氧化碳、二氧化硫、氨气与BaCl2溶液不发生化学反应,三氧化硫与BaCl2溶液反应生成硫酸钡沉淀,以此来解答.
解答:A.二氧化碳气体通入BaCl2溶液中不反应,无沉淀,故A不选;
B.二氧化硫气体通入BaCl2溶液中不反应,无沉淀,故B不选;
C.三氧化硫气体通入BaCl2溶液反应生成硫酸钡沉淀,故C选;
D.氨气气体通入BaCl2溶液中不反应,无沉淀,故D不选;
故选C.
点评:本题考查物质的性质,涉及常见的几种气体与盐溶液的反应,注意酸性的强弱及硫酸钡不溶于水、不溶于酸,题目难度不大.
本题难度:困难
5、选择题 已知A是单质,E的水溶液显强酸性。A、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生下列的转化。则A可能是
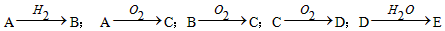
[? ]
A.Cl2
B.N2
C.S
D.C
参考答案:BC
本题解析:
本题难度:简单