|
高中化学必备知识点《未知》试题强化练习(2019年最新版)(二)
2019-06-28 20:37:58
【 大 中 小】
|
1、填空题 根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题:

据此回答问题
(1)试剂a为?试剂b为? (填写所选试剂代号)
A.浓硫酸
B.硫酸铁溶液
C.氯水
D.H2 O2和稀硫酸 E. Fe
| (2)加入过量试剂c,发生反应的离子方程式为__?;溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为__? _ _(填化学式);欲测定溶液Z中Fe2+的浓度,需要用(填仪器名称)__? __配制一定浓度的KMnO4标准溶液。在滴定时KMnO4标准溶液应加入到?(填“酸式”或“碱式”)滴定管中。
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O="=" 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为?。K2Fe04与FeCl3相比,净水效果更好的是_?,理由是?。
(4)高铁电池是一种新型可充电电池,总反应为:3Zn +2K2FeO4 +8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:?。 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:?。
参考答案:(1)D(1分)? E(1分)
(2)2Fe3++Cu=2Fe2++Cu2+(2分)? KSCN(或NH4SCN等,1分)
容量瓶(1分) 酸式(1分)
(3)2mol(2分)? K2FeO4(1分)
高铁酸钾(K2FeO4)具有强氧化性,在净水的同时还能杀菌消毒(2分)
(4)K2FeO4(2分)
本题解析:略
本题难度:简单
2、选择题 氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是
[? ]
A.这“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
参考答案:D
本题解析:
本题难度:简单
3、填空题 A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
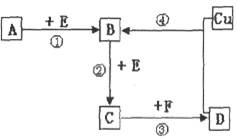
(1)若A、B、C、D均为含硫元素的化合物,A是一种常见的矿石的主要成分,且A的摩尔质量为120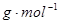 。?反应①的化学方程式为?; 。?反应①的化学方程式为?;
(2)若A、B、C、D均为含氮元素的化合物,且A的一个分子中只含有10个电子,则:
①A分子式为__________;
②反应④的离子方程式为________________________________________________?
③取Cu和Cu2O的混合物样品12.0g,加入到足量的D的稀溶液中,用排水法收集产生的气体,标准状况下其体积为2.24L,则样品中Cu2O的质量为__________g。
参考答案:(1)4FeS2+11O2 Fe2O3+8SO2;(2分) Fe2O3+8SO2;(2分)
(2)①NH3 ;(2分)
②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;(2分)
③4.32g(2分,4.3 也得分) 也得分)
本题解析:(1)A是一种常见的矿石的主要成分,且A的摩尔质量为120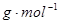 ,A是FeS2,E为氧气,则反应①的化学方程式为4FeS2+11O2 ,A是FeS2,E为氧气,则反应①的化学方程式为4FeS2+11O2 Fe2O3+8SO2; Fe2O3+8SO2;
(2)①A、B、C、D均为含氮元素的化合物,A的一个分子中只含有10个电子,则A是NH3;
②E是氧气,B是NO,C是NO2,F是水,D为硝酸,所以反应④的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
③设Cu和Cu2O的物质的量分别为x、y,根据得失电子守恒,2.24L/22.4L/mol×3=2x+2y,二者的质量为12.0g,所以有64x+144y=12,解得y=0.03mol,因此Cu2O的质量是0.03mol×144g/mol=4.32g
本题难度:困难
4、填空题 哈尔滨市场销售的某种食用精制盐包装袋上有如下说明
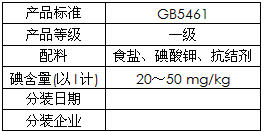
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_______________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________________。
(3)已知:I2+2S2O32-== 2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是___________________。
②b中反应所产生的I2的物质的量是____________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) _______________mg/kg。
参考答案:(1)1、5、3、3、3、3
(2)①I2+SO32-+H2O==2I-+2H++SO42-;②步骤后增加:将分液漏斗充分振荡后静置
(3)①溶液由蓝色恰好变为无色且半分钟内不恢复至原来颜色;②1×10-5;③
本题解析:
本题难度:一般
5、填空题 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ? ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s)?ΔH1=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ? ΔH3
则ΔH3=________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
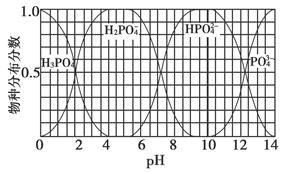
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示)。
(4)磷的化合物三氯氧磷(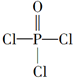 )与季戊四醇( )与季戊四醇(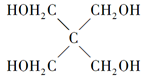 )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示: )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
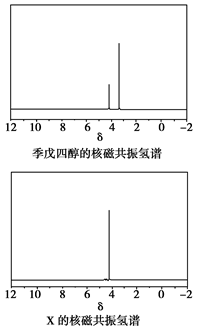
①酸性气体是______________________(填化学式)。
②X的结构简式为__________________。
参考答案:(1)2821.6 (2)3 mol (3)①4~5.5(介于此区间内的任意值或区间均可) c(HPO42—)>c(H2PO4—)
②3Ca2++2HPO42—=Ca3(PO4)2↓+2H+
(4)①HCl 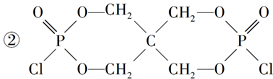
本题解析:应用化学反应原理分析相关问题,得出合理答案。
(1)2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH=+3359.26 kJ·mol-1①
CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-89.61 kJ·mol-1②根据盖斯定律,①+②×6得ΔH3=+2821.6 kJ·mol-1。
(2)该反应中,Cu2+转化为Cu+,则60 mol CuSO4转移60 mol e-, ,1 mol P4被CuSO4氧化时得20 mol e-,所以60 mol CuSO4可以氧化3 mol P4。 ,1 mol P4被CuSO4氧化时得20 mol e-,所以60 mol CuSO4可以氧化3 mol P4。
(3)根据图像可知获得纯净的NaH2PO4应控制pH在4~5.5之间。pH=8时溶质主要是Na2HPO4和NaH2PO4。此时c(HPO42—)>c(H2PO4—)。加入CaCl2后,Ca2+结合HPO42—电离出的PO42—生成沉淀,促进了HPO42—的电离,反应的离子方程式为3Ca3++2HPO42—=Ca3(PO4)2↓+2H+。
(4)根据元素种类可以判定酸性气体是HCl,根据元素守恒及反应物季戊四醇的核磁共振氢谱、生成物X的核磁共振氢谱推出反应为
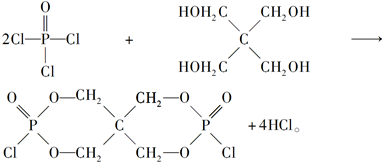
点拨:知识:反应热计算、氧化还原反应、离子浓度大小比较、离子方程式等。能力:考查学生对化学知识综合运用、解决问题的能力。试题难度:较大。
本题难度:困难
|  3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:?。
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:?。