1、实验题 近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
【实验目的】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:
(?)SO2 +(?)MnO4— +(?)?=(?)??+(?)Mn2+ +(?)?
根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
【实验探究】甲同学:甲同学进行了如下图所示A、B两步实验:
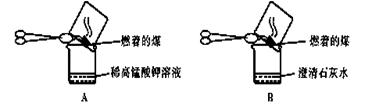
“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是:?
【实验探究】丙同学:丙同学进行了如下图所示实验(部分装置在图中略去):
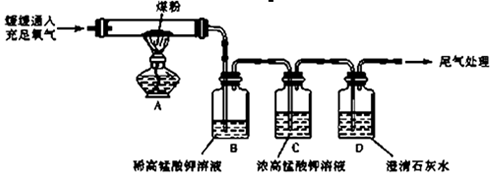
(3)上图C装置的作用是?
(4)证明煤中含有碳元素和硫元素的现象是: ?
(5)装置C中的高锰酸钾溶液也可以替换为?
A.足量I2的淀粉溶液? B.足量饱和NaHCO3溶液? C.足量Na2SO3溶液? D.足量溴水
2、填空题 储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化汽化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3、H2O七种物质。
(1)请用上述物质填空,并配平化学方程式:
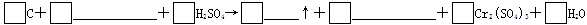
(2)上述反应中氧化剂是(填化学式)_______________,被氧化的元素是(填元素符号)_____________。
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)____________________。
A.氧化性 ?B.酸性? C.氧化性和酸性?D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________升。
3、填空题 我国了“神舟”系列载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了”
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是___________________
A.在高温下不融化
B.在高温下可分解气化
C.在常温下就分解气化
D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:
N2O4 + N2H4 → N2 + H2O 。
①请配平该反应方程式:____N2O4 + ____N2H4 → ____N2 + ____H2O
②该反应中被氧化的原子与被还原的原子物质的量之比是____________。
③这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是________________________。
(3)为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。
①写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似):
______________________;_________________________。
②你选择的供氧剂是:____________________,原因是:____________________________。
4、计算题 3.16 g KMnO4与50mL 12 mol·L-1过量浓盐酸完全反应(假设浓盐酸无挥发),化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl 2+ 5Cl2↑+8H2O,?通过计算回答:
(1)未被氧化的HCl的物质的量是?;
(2)产生的Cl2在标准状况下的体积为多少升?
(3)在反应后的溶液中加足量的AgNO3溶液可生成多少克沉淀?
5、实验题 (7分)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米管伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其原理可表示为:
□C+ □K2Cr2O7+ □H2SO4=□CO2+ □Cr2(SO4)3+ □K2SO4+□H2O
(1)请配平上述化学方程式, 将有关的化学计量数依次填在下列横线上
??、?、?、?、?、?、?
(2)上述反应中的氧化剂是(填化学式,下同)?,还原剂是?。
(3)H2SO4在上述反应中表现出的性质是(填选项序号)?。
A.氧化性
B.氧化性和酸性
C.酸性
D.还原性和酸性