|
高中化学知识点讲解《盐类水解的原理》典型例题(四)
2019-06-28 20:39:20
【 大 中 小】
|
1、选择题 常温时,向pH=12的Ba(OH)2溶液中加入等体积的下列溶液后,滴入酚酞试液出现红色,该溶液应该是
A.pH=2的硫酸溶液
B.pH=2的醋酸溶液
C.0.05mol/L盐酸溶液
D.0.05mol/LNa2SO4溶液
|
参考答案:D
本题解析:
常温下,酚酞试液的变色范围:8-10,滴入酚酞试液出现红色,说明混合液显碱性。
A、向pH=12的Ba(OH)2溶液中加入等体积的pH=2的硫酸溶液,二者的氢离子和氢氧根恰好完全反应,呈中性,故A不合题意;
B、向pH=12的Ba(OH)2溶液中加入等体积的pH=2的醋酸溶液,醋酸过量,混合液显酸性,故B不合题意;
C、向pH=12的Ba(OH)2溶液中加入等体积的0.05mol/L盐酸溶液,盐酸过量,混合液显酸性,故C不合题意;
D、向pH=12的Ba(OH)2溶液中加入等体积的0.05mol/LNa2SO4溶液,反应生成硫酸钡沉淀和氢氧化钠,混合液显碱性,故D符合题意。
考点:考查酸碱中和反应、指示剂的变色范围
点评:本题考查了酸碱中和反应、指示剂的变色范围,难度不大。易错点是涉及到弱酸的PH与酸的浓度的关系,如B项,误以为是酸碱恰好完全反应。
本题难度:一般
2、选择题 在Na2S水溶液中c(Na+)与c(S2-)的关系是
A.c(Na+)=2c(S2-)
B.c(Na+)<2c(S2-)
C.c(Na+)>2c(S2-)
D.2c(Na+)>c(S2-)
参考答案:C
本题解析:S2-部分水解,这样c(Na+)>2c(S2-).
本题难度:一般
3、选择题 在10mL?0.1mol·L—1NaOH溶液中加入同体积同浓度的CH3COOH溶液,反应后溶液中各粒子浓度关系错误的是
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
参考答案:A
本题解析:混合后为醋酸钠的溶液;该溶液水解呈碱性故有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),A错误,B正确;C、为物料守恒;D、为电荷守恒。
本题难度:简单
4、填空题 (10分)(1)同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4,其中c(NH4+) 由小到大的顺序是 (填序号,下同)。
(2)同浓度的下列溶液:①(NH4)2SO4 ②NH4Cl ③Na2CO3 ④NaHCO3,其中pH 由大到小的顺序是 。
(3)现有下列物质①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡固体⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液 请用以上物质回答下列问题。
属于强电解质且在上述状态下能导电的是 ;
属于弱电解质的是 ;
属于非电解质,但溶于水后的水溶液能导电的是 。
参考答案:(1)③②①(2)③④②①(3)⑦ ③ ②
本题解析:(1)铝离子抑制铵根离子水解,醋酸根离子促进铵根离子水解,铵根离子水解程度越大,则相同浓度的铵盐溶液中铵根离子浓度越小,所以相同浓度的这三种盐,c(NH4+) 由小到大的顺序是③②①,
(2)硫酸铵和氯化铵为强酸弱碱盐,其溶液呈酸性,相同浓度的硫酸铵和氯化铵溶液中,硫酸铵水解程度小于氯化铵,但硫酸铵中铵根离子水解个数多,所以硫酸铵pH最小;碳酸氢钠和碳酸钠溶液都呈碱性,但碳酸根离子水解程度大于碳酸氢根离子,所以相同浓度的碳酸钠和碳酸氢钠,碳酸钠的pH最大,则相同浓度的这四种溶液中,pH由大到小的顺序是③④②①,
(3)有自由移动的电子或自由移动的离子的物质能导电;水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质,完全电离的电解质为强电解质,部分电离的电解质为弱电解质,在上述两种情况下都不能导电的化合物称为非电解质,SO2、酒精等都是非电解质;单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质,所以属于强电解质且在上述状态下能导电的是⑦; 属于弱电解质的是 ③;属于非电解质,但溶于水后的水溶液能导电的是②。
考点:考查离子浓度的大小比较,PH值的大小比较,电解质、非电解质的概念等知识。
本题难度:一般
5、选择题 下列能正确表示水解的离子方程式是
A.CH3COOH + H2O 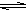 CH3COO- + H3O+ CH3COO- + H3O+
B.NH4+ + H2O 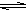 NH3·H2O + H+ NH3·H2O + H+
C.CO32- + 2H2O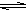 H2CO3 + 2OH- H2CO3 + 2OH-
D.Br- + H2O 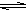 HBr + OH- HBr + OH-
| 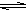 HCO3- + OH-,错误;D、溴离子不会发生水解,错误。
HCO3- + OH-,错误;D、溴离子不会发生水解,错误。