| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《盐类水解的原理》典型例题(一)
2、填空题 (14分)氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。 A.容器内NH3的浓度保持不变 B.2υ( N2)正= υ( H2)逆 C.容器内压强保持不变 D.混合气体的密度保持不变 (4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 ) 。 ②25℃时,将pH =x氨水与pH =y的硫酸(且x + y =" 14," x > 11 )等体积混合后,所得溶液中各种离子的浓度关系正确的是 A.c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(SO42-)>c(OH-)>c(H+) C.c(NH4+)+c(H+)>c(SO42-)+c(OH-) D.c(NH4+)>c(SO42-)>c(H+)>c(OH-) 3、选择题 常温下,用 0.1000 mol·L |
4、选择题 下列水解的离子方程式正确的是
[? ]
A.Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.Br-+H2O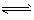 HBr+OH-
HBr+OH-
C.CO32-+H2O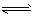 H2CO3+2OH-
H2CO3+2OH-
D.NH4++ H2O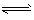 NH3·H2O +H+
NH3·H2O +H+
5、选择题 25℃时,在20 mL 0.1 mol·L-1盐酸中逐滴加入0.2 mol·L-1的氨水,溶液的pH与所加氨水的体积关系如图所示,下列有关粒子浓度的关系不正确的是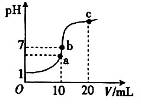
A.在b点,盐酸与氨水恰好完全中和
B.在b点:c(H+)=c(OH-),c(NH4+)=c(Cl-)
C.在a点:c(Cl-)> c(NH4+)> c(H+)> c(OH-)
D.在c点:c(NH4+)+ c(NH3·H2O)="2" c(Cl-)
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《电解池原理.. | |