1、选择题 在理论上可用来设计原电池的反应是
A.Fe +2HCl =FeCl2+ H2
B.NaOH +HCl=NaCl+H2O
C.Cu SO4 +2NaOH= Cu(OH)2+Na2 SO4
D.Ca CO3+2HCl=CaCl2+ H2O+ CO2
参考答案:A
本题解析:试题分析:常温能自发进行的氧化还原反应可设计成原电池,有元素化合价变化的反应为氧化还原反应,以此来解答。A中反应是置换反应,属于氧化还原反应,能用于设计原电池,A正确;B中反应是中和反应、C和D中都是复分解反应,反应中没有元素的化合价变化,不是氧化还原反应,因此不能用于设计原电池,故BCD均不符合题意,因此答案选A。
考点:考查原电池设计的有关判断
点评:该题是高考中的常见题型,属于基础性试题的考查,侧重对学生基础知识的巩固和训练。明确能自发进行的氧化还原反应能设计成原电池是解答本题的关键,准确判断出反应中有关元素的化合价变化是前提。
本题难度:简单
2、选择题 用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是
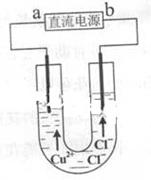
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
参考答案:A
本题解析:与电源的正极的电极为阳极,带正电,溶液中阴离子向阳极移动,根据图示可知,b为电源的正极,a为电源的负极,A正确;CuCl2溶于水就发生电离,不需要通电,B不正确;阴离子Cl-在阳极上发生氧化反应2Cl--2e-=Cl2,C不正确;阴离子Cl-在阳极上发生氧化反应2Cl--2e-=Cl2,通电一段时间后,应在阳极附近观察到黄绿色气体,D不正确。
本题考查电解原理。
本题难度:一般
3、填空题 研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl ?
(1)该电池的负极反应式是_______; ?
(2)在电池中,Na+不断移动到“水”电池的_______极(填“正”或“负”); ?
(3)外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是_______。
参考答案:(1)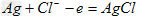
(2)正
(3)2mol
本题解析:
本题难度:一般
4、填空题 (本小题14分)现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________(填“增大”、“不变”或“减小”)。
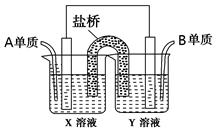
参考答案:(本小题14分,每空2分)(1)第三周期ⅥA族
(2)离子键、共价键(或非极性共价键) ; 2Na2O2+2H2O===4Na++4OH-+O2↑;
(3) (4) S2-+H2O
(4) S2-+H2O HS-+OH-;(5) O2+4H++4e-===2H2O ;减小。
HS-+OH-;(5) O2+4H++4e-===2H2O ;减小。
本题解析:根据题意可知:A是H;B是O;C是Na;D是S。(1)元素D在周期表中的位置是第三周期ⅥA族;(2)C2B2是Na2O2;属于离子化合物,在所含的化学键类型有离子键、非极性共价键;C2B2与A2B反应的离子方程式是2Na2O2+2H2O===4Na++4OH-+O2↑;(3)元素B、C形成的简单离子电子层结构相同,离子的核电荷数越大,离子半径就越小。所以离子半径较大的是O2-,其电子式是 ;(4)仅由C、D两种元素组成的一种盐Na2S是强碱弱酸盐,弱酸根离子S2-水解消耗水电离产生的H+,破坏了水的电离平衡,使水继续电离,最终当溶液达到电离平衡时,c(H+)<c(OH-),所以溶液显碱性, pH>7,用离子方程式表示是S2-+H2O
;(4)仅由C、D两种元素组成的一种盐Na2S是强碱弱酸盐,弱酸根离子S2-水解消耗水电离产生的H+,破坏了水的电离平衡,使水继续电离,最终当溶液达到电离平衡时,c(H+)<c(OH-),所以溶液显碱性, pH>7,用离子方程式表示是S2-+H2O HS-+OH-;(5)以C、D两元素的最高价氧化物的水化物X—NaOH、Y—H2SO4的溶液作为电解质溶液,A、B元素的单质H2、O2分别在两电极上发生原电池反应,则通入B单质的电极反应式为O2+4H++4e-===2H2O;通入A单质的电极反应式为H2-2e-+2OH-=2H2O,由于c(OH-)不断减小,所以溶液的pH会增大。
HS-+OH-;(5)以C、D两元素的最高价氧化物的水化物X—NaOH、Y—H2SO4的溶液作为电解质溶液,A、B元素的单质H2、O2分别在两电极上发生原电池反应,则通入B单质的电极反应式为O2+4H++4e-===2H2O;通入A单质的电极反应式为H2-2e-+2OH-=2H2O,由于c(OH-)不断减小,所以溶液的pH会增大。
考点:考查元素及化合物的推断、物质的电子式、离子方程式和原电池的电极反应式的书写的知识。
本题难度:困难
5、选择题 下列烧杯中盛放的都是稀硫酸,在铜棒上不能产生气泡的是( )
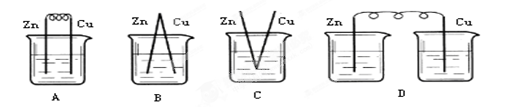
参考答案:D
本题解析:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应。原电池中正极上发生还原反应,负极上发生氧化反应。A、B、C三个装置中均构成构成原电池,铜作正极,正极上氢离子得电子生成氢气;D、该装置没有形成闭合回路,所以铜极上没有气泡产生,所以正确的答案选D。
考点:考查原电池的判断及电极反应
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。明确原电池的工作原理、构成条件是答题的关键。
本题难度:简单