|
高中化学知识点总结《原电池原理》考点巩固(2019年最新版)(六)
2019-06-28 20:49:35
【 大 中 小】
|
1、选择题 如图为铜锌原电池示意图,下列说法正确的是( )
A.锌片逐渐溶解
B.烧杯中溶液逐渐呈蓝色
C.电子由铜片通过导线流向锌片
D.该装置能将电能转变为化学能
| 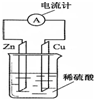
参考答案:A、因Zn作负极,则Zn失去电子而逐渐溶解,故A正确;
B、由发生电池反应为Zn+H2SO4═ZnSO4+H2↑,Cu不反应,则烧杯中溶液为无色,故B错误;
C、Zn作负极,Cu作正极,则电子由锌片通过导线流向铜片,故C错误;
D、该装置通过化学反应将化学能转变为电能,故D错误;
故选A.
本题解析:
本题难度:简单
2、填空题 (10分) 以铁、铜为两电极,稀硫酸为电解质所构成的原电池:
(1)导线中电流流向 ( 选填“铁”或“铜”) ,电极Fe是_____(选填“正”或“负”) 极,其电极反应式为 ;
(2)Cu电极的电极反应式为 ,发生 反应(选填“氧化”或“还原”);
(3)该原电池反应的总反应式(写对应的离子方程式)是: & #160; ,通过该原电池装置实现了从化学能向 的转化。
参考答案:(1)铁;负;Fe - 2e-= Fe2+ (2)2H+ + 2e-= H2↑;还原
(3)Fe + 2H+= Fe2+ + H2↑;电能
本题解析:略
本题难度:一般
3、实验题 (8分)某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为 。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。

正极反应式: ;负极反应式: 。
若该电池中有0.1mol的电子转移,请问消耗 克Fe
方案Ⅲ.结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同): __________________,用离子方程式表示其反应原理:______________
参考答案:(共8分)
方案Ⅰ:Fe+2H+=Fe2++H2↑(1分)
方案Ⅱ:(画装置图完全正确2分,合理的均给分)

2H++2e- =H2↑(1分) Fe-2e-=Fe2+(1分) 2.8 g
方案Ⅲ:把铁片插入CuSO4溶液中,一段时间后,观察铁片表面是否生成红色物质(1分)Fe+Cu2+ = Cu+Fe2+(1分)
本题解析:金属的活动性有多种验证方法。例如与水和酸置换氢气的能力;最高价氧化物水化物的碱性强弱;原电池原理;电解原理的应用、金属之间的置换等等。
本题难度:一般
4、选择题 Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式:2AgCl+ Mg = Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是
A.Mg为电池的正极
B.负极反应为AgCl+e-=Ag+Cl-
C.不能被KCl溶液激活
D.可用于海上应急照明供电
参考答案:D
本题解析:Mg的化合价升高,为电源的负极,A、B都错;KCl是电解质溶液,导电能力强于海水,能激活该电池,C错;答案选D。
本题难度:一般
5、选择题 某原电池总反应为:Cu+2Fe3+==Cu2++2Fe2+下列能实现该反应的原电池是
?
| A
| B
| C
| D
| 电极材料
| Cu、Zn
| Cu、Ag
| Cu、C
| Fe、Zn
| 电解液
| FeCl3
| Fe2(SO4)3
| Fe(NO3)2
| CuSO4
参考答案:B
本题解析:A中负极是锌、正极是铜,电池反应为Zn+2Fe3+=2Fe2++Zn2+,A错误;B中负极是铜、正极是银,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,B正确;C中没有自发的氧化还原反应,不能形成原电池,但能产生电动势,C错误;D中锌是负极,铁是正极,电池反应为Zn+Cu2+=Zn2++Cu,D错误。
点评:原电池中负极失电子,发生氧化反应,正极上发生还原反应,书写电极反应时要注意介质。
本题难度:一般
|
|
