1、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)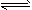 CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表
CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表
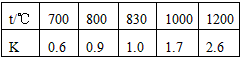
回答下列问题
(1)该反应的化学平衡常数表达式为K=___________。
(2)该反应为___________反应(填“吸热”“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是___________
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃
参考答案:(1)K=[c(CO)·c(H2O)]/[c(CO2)·c(H2)]
(2)吸热
(3)BC
(4)830
本题解析:
本题难度:一般
2、选择题
反应A2+B2?2AB,在不同温度和压强改变的条件下,产物AB的AB%生成情况如图;a为500℃时的情况:b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )
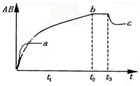
A.A2、B2及AB均为气体,△H<0
B.AB为气体,A2、B2中至少有一种为非气体,△H<0
C.AB为气体,A2、B2中有一种为非气体,△H>0
D.AB为固体,A2、B2中有一种为非气体,△H<0
参考答案:B
本题解析:
本题难度:简单
3、填空题 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和反应②,用CH4和H2O为原料来制备甲醇(CH3OH).
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1
②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol?CH4和0.30mol?H2O(g)通入容积为10L的密闭容器中,在一定条件下发生①反应,达到平衡时,CH4的转化率与温度、压强的关系如图.
(1)温度不变,缩小体积,增大压强,①的反应速率______(填“增大”、“减小”或“不变”),平衡向______方向移动.
(2)反应①的△H1______0(填“<”、“=”或“>”).
(3)如果反应①达到平衡时所用的时间为2min,求CH4的反应速率及化学平衡常数的值.(写出计算过程).
(4)在100℃压强为0.1MPa条件下,将a?mol?CO与?3a?mol?H2的混合气体在催化剂作用下进行②反应,生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填入剩余的实验条件数据.
| 实验编号 | T(℃) | n?(CO)/n(H2) | P(MPa)
I
150
0.1
II
5
III
350
5
|

参考答案:(1)温度不变,缩小体积增大压强,反应速率增大,平衡向气体体积减小的方向移动,即反应①向逆反应移动,
故答案为:增大;逆反应;
(2)采取控制变量法分析,由图可知压强相同时,到达平衡时,温度越高CH4的转化率越大,升高温度平衡向正反应移动,故正反应为吸热反应,即△H>0,
故答案为:>;
(3)由100℃平衡CH4的转化率为0.5可知,消耗CH4为0.2mol×0.5=0.1mol,平衡时甲烷的浓度变化量为0.1mol10L=0.01mol/L,故v(CH4)=0.01mol/L2min=0.005mol/(L?min);
平衡时甲烷的浓度变化量为0.1mol10L=0.01mol/L,则:
?CH4(g)+H2O(g)?CO(g)+3H2(g)
开始(mol/L):0.02?0.03?0? 0
变化(mol/L):0.01? 0.01? 0.01? 0.03
平衡(mol/L):0.01? 0.02? 0.01? 0.03
故100℃时平衡常数k=0.033?×0.010.02×0.01=1.35×10-3,
答:CH4的反应速率为0.005mol/(L?min);100℃时平衡常数化学平衡常数的值为1.35×10-3;
(4)通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,由此可得:Ⅱ中温度为150℃,n?(CO)/n(H2)为13,Ⅲ中n?(CO)/n(H2)为13,
故答案为:实验编号T(℃)n?(CO)/n(H2)P(MPa)III15013III13.
本题解析:
本题难度:一般
4、填空题 硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6+6H2O=2H3BO3+________。
(2)在其他条件相同时,反应H3BO3+3CH3OH?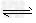 B(OCH3)3?+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,
B(OCH3)3?+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,
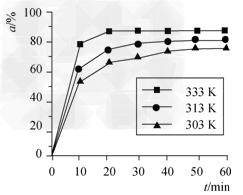
由此图可得出: ?
①温度对该反应的反应速率和平衡移动的影响是__________________。
②该反应的ΔH________0(填“<”“=”或“>”)。
(3)H3BO3溶液中存在如下反应: H3BO3(aq)+H2O(l)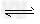 [B(OH)4]-(aq)+H?+(aq)已知0.70?mol/L?H3BO3溶液中,上述反应于298?K达到平衡时,c平衡(H+)=2.0×10-5?mol/L,c平衡(H3BO3)≈c起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K_________H2O的平衡浓度不列入K的表达式中(计算结果保留两位有效数字)。
[B(OH)4]-(aq)+H?+(aq)已知0.70?mol/L?H3BO3溶液中,上述反应于298?K达到平衡时,c平衡(H+)=2.0×10-5?mol/L,c平衡(H3BO3)≈c起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K_________H2O的平衡浓度不列入K的表达式中(计算结果保留两位有效数字)。
参考答案:(1)6H2
(2)①升高温度,反应速率加快,平衡正向移动? ;②>
(3)5.7×10-10 mol/L
本题解析:
本题难度:一般
5、简答题 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
①用O2表示的反应的平均速率为______;
②平衡时SO2的转化率______;
③平衡时SO3的体积分数为______;
④10s时O2的浓度为______.
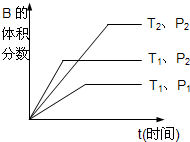
(2)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强p与反应物B的体积分数的关系曲线.根据图象填空
①化学计量数的关系:m+n______q;(填“>”,“<”或“=”)
②该反应的正反应为______反应.(填“吸热”或“放热”)
参考答案:(1)在一定温度下,将4mol SO2与2molO2放入2L的密闭容器中,c(SO2)=2mol/L,c(O2)=1mol/L,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1;
设转化的氧气的物质的量浓度为x,则
2SO2 +O2 ?2SO3
开始(mol?L-1) 2 1 0
转化(mol?L-1) 2x x 2x
平衡(mol?L-1) 2-2x 1-x 2x
平衡时测得SO3的浓度为0.6mol?L-1;
所以2x=0.6mol?L-1,解得x=0.3mol?L-1,
①10s内氧气的浓度变化为△c(O2)=0.3mol?L-1,所以v(O2)=△ct=0.3mol?L-110s=0.03mol/(L?s),
故答案为:0.03mol/(L?s);
②平衡时SO2的转化率为:n(反应)n(加入)=0.62×100%=30%,
故答案为:30%;
③平衡时的容器内的总浓度为:2-2x+1-x+2x=2.7mol?L-1,所以平衡时SO3的体积分数0.62.7×100%=22.2%,
故答案为:22.2%;
④平衡时氧气的浓度:1-x=0.7mol?L-1,
故答案为:0.7mol?L-1;
(2)①定温度相同,比较压强不同时,即比较曲线T1、p1与曲线T1、p2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以p1<p2,
由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n<q,
故答案为:<;
②定压强相同,比较温度不同时,即比较曲线T1、p2与曲线T2、p2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1>T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应,
故答案为:吸热.
本题解析:
本题难度:简单