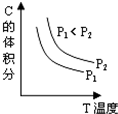
1、填空题 已知反应:aA(g)+bB(g)?cC(g)
根据图形推测:
(1)P1______P2?(?填>或<)
(2)a+b______c?(?填>或<)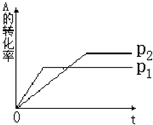
2、填空题 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: ___?C+?___?KMnO4+?____?H2SO4→____CO2↑+?____MnSO4?+?____K2SO4+?____H2O?
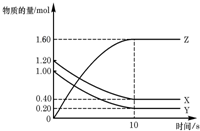
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据
CO2(g)+H2(g),得到如下三组数据
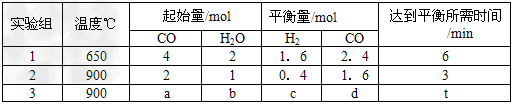
①实验1条件下平衡常数K=________(取小数二位,下同)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b?的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时
V正_____V逆(填“>”、“<”“=”)。
(3)已知在常温常压下:
①?2CH3OH(l)?+?3O2(g)?=?2CO2(g)?+?4H2O(g)?ΔH?=?-1275.6?kJ/mol
②?2CO?(g)+?O2(g)?=?2CO2(g)?ΔH?=?-566.0?kJ/mol
③?H2O(g)?=?H2O(l)?ΔH?=?-44.0?kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________
(4)为最近有科学家提出构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。该构想技术流程如下

向分解池中通入高温水蒸气的作用是_______________________________
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L?,则生成沉淀所需CaCl2溶液的最小浓度为
__________。
3、简答题 (1)二氧化硫的催化氧化的过程如图1所示,
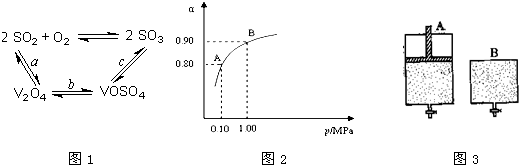
其中a、c二步的化学方程式可表示为:SO2+V2O5?SO3+V2O4
4VOSO4+O2?2V2O5+4SO3.
该反应的催化剂是______(写化学式)
(2)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图2所示.将2.0molSO2和1.0molO2置于5L密闭容器中,反应达平衡后,体系总压强为0.10MPa.试计算反应2SO3?2SO2+O2在550℃时的平衡常数K=______.
(3)550℃时,将2.0molSO2和1.0molO2置于5L密闭容器中,反应达平衡后,下列措施中能使
增大的是______
A.升高温度B.充入He(g),使体系总压强增大
C.再充入2molSO2和1molO2D.再充入1molSO2和1molO2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2?2SO3,有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图3所示).
试填写下列空格:
A容器达到平衡时所需的时间比B容器______(填:“短”或“长”);平衡时A容器中SO2的转化率比B容器______(填:“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数______(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数______.
4、选择题 已知某可逆反应aA(g)+bB(g)?cC(g)+dD(g).反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的( )
A.正反应为吸热反应
B.降低温度,正反应速率增大
C.a+b<c+d
D.增大压强,B转化率增大