1、填空题 (6分)利用氧化还原反应原理配平以下化学方程式,并:
FeSO4 + KNO3 + H2SO4 === K2SO4 + Fe2(SO4)3 + NO↑+ H2O
(1)标出电子转移的方向和数目
(2)当电子转移了0.3mol时,有?g氧化剂参加反应
参考答案:

本题解析:略
本题难度:简单
2、选择题 关于反应3Cl2 + 6KOH 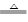 ?KClO3 + 5KCl + 3H2O,以下说法正确的是
?KClO3 + 5KCl + 3H2O,以下说法正确的是
A.KOH既不是氧化剂,又不是还原剂
B.Cl2是氧化剂,KOH是还原剂
C.3mol氯气参加反应转移6 mol电子
D.被氧化的氯元素的质量为被还原的氯元素质量的5倍
参考答案:A
本题解析:反应中Cl由0价升为+5价、0价降为-1价,Cl2既是氧化剂又是还原剂,故KOH既不是氧化剂,又不是还原剂,A正确,B、C错误;被氧化的氯原子与被还原的氯原子物质的量比为1:5,D错误。
本题难度:一般
3、选择题 xR2++yH++O2?mR3++2H2O中,对m和R3+判断正确的是
A.m=4,R2+是氧化剂
B.2m=y,R3+是氧化剂
C.m=4,R3+是氧化产物
D.m=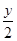 ,R3+是还原剂
,R3+是还原剂
参考答案:C
本题解析:由化合价的变化可以看到:R2+→R3+化合价升高,所以R2+做还原剂,R3+是氧化产物;
O2→H2O氧元素的化合价从0→-2,所以氧气是氧化剂,水是还原产物;由R 原子守恒得:x=m
由H原子守恒得:y=4;由电荷守恒得:2x+y=3m,由此可得m=x=y=4,故选C。
点评:本题考查的是氧化还原反应知识,学生要熟悉氧化还原反应的概念规律,此类问题很容易的得到解决。
A、氧化性、还原性的判断
①氧化性是指得电子的能力,还原性是指失电子的能力。
②氧化性、还原性的强弱取决于得失电子的难易程度,与得失电子的多少无关。
氧化剂得电子,化合价降低,具有较强氧化性;氧化产物具有较弱氧化性;(因此可判断物质的氧化性强弱)
还原剂失电子,化合价升高,具有较强还原性;还原产物具有较弱还原性;(因此可判断物质的还原性强弱)
B、相等规律:
在任何氧化还原反应中,氧化剂得到电子的总数与还原剂失去电子的总数相等。此规律应用于解氧化还原反应的计算题、氧化还原反应方程式的配平。
本题难度:一般
4、选择题 已知锌溶于稀硝酸中可发生如下反应:4Zn+10HNO3==4Zn(NO3)2+N2O↑+5H2O,该反应中被还原的硝酸与未被还原的硝酸的质量比是
A.2∶5
B.1∶4
C.4∶1
D.5∶1
参考答案:B
本题解析:此反应中元素的化合价变化情况为:  ,即参加反应的10个HNO3中的+5价N,反应生成了4个Zn(NO3)2中+5价的N,即化合价未发生变化,又生成了1个N2O中的+1价的N,化合价降低被还原,故从生成的4个Zn(NO3)2中可看出有8各+5价N未变化,生成1各N2O中有2个+5价生成了2个+1价的N,故被还原的HNO3是2,即得被还原的HNO3和未被还原的HNO3的个数比是2:8,即1:4,因此得被i还原的HNO3和未被还原的HNO3的质量比是:(1*63):(4*63)=1:4。
,即参加反应的10个HNO3中的+5价N,反应生成了4个Zn(NO3)2中+5价的N,即化合价未发生变化,又生成了1个N2O中的+1价的N,化合价降低被还原,故从生成的4个Zn(NO3)2中可看出有8各+5价N未变化,生成1各N2O中有2个+5价生成了2个+1价的N,故被还原的HNO3是2,即得被还原的HNO3和未被还原的HNO3的个数比是2:8,即1:4,因此得被i还原的HNO3和未被还原的HNO3的质量比是:(1*63):(4*63)=1:4。
故选B。
点评:本题考查的是有关硝酸的氧化性的相关知识,解答此题需要学生能正确的分析出化学反应中元素化合价的变化情况。
本题难度:一般
5、填空题 (1)在标准状况下,3.55g氯气的体积是______L,将其与氢气完全化合需氢气的物质的量是______mol,将生成的气体制成100mL溶液,溶质的物质的量浓度是______mol?L-1,将此溶液取出20mL加蒸馏水稀释成500mL溶液,此稀稀后的溶液中溶质的物质的量浓度是______mol?L-1.
(2)写出下列反应的化学方程式:
①镁在二氧化碳中燃烧反应:______.
②实验室用二氧化锰与浓盐酸反应制取氯气:______.
③金属铜与浓硫酸加热反应:______.
(3)白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸.已知白磷和氯酸溶液可发生如下反应:
______P4+______HClO3+______=______HCl+______H3PO4
配平并完成上述反应方程式,该反应的氧化剂是______;若有1mol?P4反应,则有______mol电子转移.
参考答案:(1)n(Cl2)=3.55g71g/mol=0.05mol,V(Cl2)=0.05mol×22.4L/mol=1.12L,
根据反应方程式H2+Cl2=2HCl计算需氢气的物质的量为0.05mol,生成0.1molHCl,
将生成的气体制成100mL溶液,溶质的物质的量浓度是c(HCl)=0.1mol0.1L=1moL/L,
将此溶液取出20mL加蒸馏水稀释成500mL溶液,此稀稀后的溶液中溶质的物质的量浓度是c=0.02L×1mol/L0.5L=0.04mol/L,
故答案为:1.12;0.05;1;0.04;
(2)①镁在二氧化碳中燃烧反应生成氧化镁和碳,反应的化学方程式为2Mg+CO2?点燃?.?2MgO+C,
故答案为:2Mg+CO2?点燃?.?2MgO+C;
②二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,反应的化学方程式为MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;
③铜和浓硫酸在加热条件下发生氧化还原反应生成硫酸铜、二氧化硫和水,
反应的化学方程式为Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O;
(3)反应中P元素的化合价由0价升高到+5价,Cl元素的化合价由+5价降低到-1价,根据得失电子数目相等可知二者计量数之比为3:10,则结合质量守恒定律可知平衡后的化学方程式为3P4+10HClO3+18H2O=10HCl+12H3PO4,反应中
HClO3为氧化剂,若有1mol?P4反应,则转移的电子的物质的量为4×(5-0)mol=20mol,
故答案为:3P4+10HClO3+18H2O=10HCl+12H3PO4;HClO3;20.
本题解析:
本题难度:一般