1、选择题 24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为? ( )。
A.+2
B.+3
C.+4
D.+5
2、选择题 某氮的氧化物和CO在催化剂存在下充分反应,生成物质的量之比为1︰2的N2和CO2,该氧化物是(?)
A.N2O
B.NO
C.NO2
D.N2O5
3、选择题 氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.Al2O3是氧化剂,C是还原剂
B.每生成1molCO需转移2mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41
4、填空题 (本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是 ;
24.碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是 ;液溴的保存通常采取的方法是 。
26.通过比较___________或________________可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:
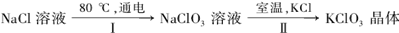
①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O 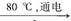 □NaClO3+ □
□NaClO3+ □
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________。
5、选择题 已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中M的化合价为
A.+2
B.+3
C.+4
D.+6