1、选择题 24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为? ( )。
A.+2
B.+3
C.+4
D.+5
参考答案:B
本题解析:题目中指出被还原的元素是Cr,则得电子的物质必是K2Cr2O7,失电子的物质一定是Na2SO3,其中S元素的化合价从+4→+6;而Cr元素的化合价将从+6→+n(设化合价为n)。根据氧化还原反应中得失电子守恒规律,有0.05 mol·L-1×0.024 L×(6-4)=0.02? mol·L-1×0.020 L×2×(6-n),解得n=3。
本题难度:一般
2、选择题 某氮的氧化物和CO在催化剂存在下充分反应,生成物质的量之比为1︰2的N2和CO2,该氧化物是(?)
A.N2O
B.NO
C.NO2
D.N2O5
参考答案:B
本题解析:氮气是还原产物,CO2是氧化产物。根据得失的得失守恒可知,生成1mol氮气,转移4mol电子,所以平均1个氮原子得到2个电子,因此氧化物中氮元素的化合价是+2价,选项B正确,答案选B。
本题难度:一般
3、选择题 氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.Al2O3是氧化剂,C是还原剂
B.每生成1molCO需转移2mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41
参考答案:B
本题解析:该反应中氮元素的化合价由0价降到-3价,被还原,氮气作氧化剂。碳元素由0价升高到+2价,被氧化、碳作还原剂,A、C错;B、正确;D、摩尔质量要带单位。
本题难度:一般
4、填空题 (本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是 ;
24.碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是 ;液溴的保存通常采取的方法是 。
26.通过比较___________或________________可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:
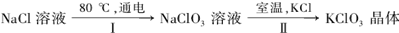
①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O 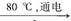 □NaClO3+ □
□NaClO3+ □
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________。
参考答案:23.2p (1分) 24.第五周期ⅦA族(1分) 离子键、共价键(1分)
25.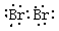 (1分) 水封在棕色瓶中,密闭保存(1分)
(1分) 水封在棕色瓶中,密闭保存(1分)
26.HCl和HBr的气态氢化物的热稳定性、HClO4和HBrO4的酸性 (2分)(合理即可)
27.①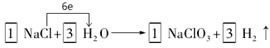 (H2 、系数1分,方向数目1分)
(H2 、系数1分,方向数目1分)
②室温下,氯酸钾在水中的溶解度明显小于其它晶体(1分)
28.4CuCl(s) + O2(g)=2CuCl2(s) + 2CuO(s)ΔH=—177.6kJ/mol (2分)
本题解析:23.与氯元素同族的短周期元素F元素的原子核外有9个电子,其核外电子排布式是1s22s22p5。可见其能量最高的电子所处的电子亚层是2p亚层;
24.53号元素碘元素核外有5个电子层,最外层有7个电子,所以在元素周期表中的位置是第五周期ⅦA族;为防缺碘,食盐中常添加碘酸钾,该物质是离子化合物,内存在离子键、极性共价键;
25.溴单质是唯一常温下呈液态的非金属单质,它是双原子分子,两个原子共用一对电子,都达到8个电子的稳定结构。它的电子式是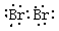 ;液溴容易挥发,由于其密度比水大,在水中溶解度不大,所以液溴通常保存采取在棕色瓶内,并加水形成水封,密封保存。
;液溴容易挥发,由于其密度比水大,在水中溶解度不大,所以液溴通常保存采取在棕色瓶内,并加水形成水封,密封保存。
26.元素的非金属性越强,其相应的氢化物的稳定性就越强。最高价的含氧酸的酸性也越强。所以可以通过比较HCl和HBr的气态氢化物的热稳定性、HClO4和HBrO4的酸性可以判断氯、溴两种元素非金属性强弱。
27.①由于在反应中Cl元素的化合价升高,则根据氧化还原反应的规律,还应该有元素的化合价降低,只有H元素符号该性质,得到电子变为H2,结合电子守恒及原子守恒可得方程式为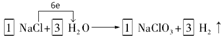
②II反应过程能析出KClO3晶体而无其它晶体析出是因为室温下,氯酸钾在水中的溶解度明显小于其它晶体
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,根据题意可得该反应的热化学方程式是4CuCl(s) + O2(g) = 2CuCl2(s) + 2CuO(s) ΔH=—177.6kJ/mol。
考点:考查原子核外电子的排布、物质内的化学键的类型的判断、物质电子式的书写、物质的保存、元素非金属性强弱比较、氧化还原反应方程式的配平及热化学方程式的书写的知识。
本题难度:困难
5、选择题 已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中M的化合价为
A.+2
B.+3
C.+4
D.+6
参考答案:D
本题解析:略
本题难度:一般