1、填空题 (10分)工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行。第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4。试回答以下问题:
(1)制取K2MnO4的MnO2是这一氧化还原反应的_____________剂(填“氧化”或“还原”),连续搅拌的目的是________________________________。
(2)电解K2MnO4的浓溶液时,两极发生的电极反应式为:
阴极是_______________________,
阳极是_________________________,
电解总的反应方程式是_________________________。
参考答案:(10分,每空2分)(1)还原剂;与空气充分接触,使MnO2氧化完全
(2)2H++2e-==H2↑,MnO42—-e-="==" MnO4-,2K2MnO4+2H2O==2KMnO4+2KOH+ H2↑
本题解析:略
本题难度:一般
2、填空题 (本题共13分)A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E顺序增大;C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB可与EA2反应生成C2A和气体物质EB4;EB4蒸气的密度是相同条件下空气密度的3.586倍。
23、指出A在元素周期表中的位置_________。
24、写出D2A2的电子式__________;写出CB与EA2反应的化学方程式___________________。
25、下表是不同物质中的键长和键能的数据,其中a、b、d未知,通过表中的数据分析,估计出a、b、c、d的大小顺序为______________________________。
共价键
| C-C
| C=C
|  C C C C
| C-O
| C=O
| H-F
| N=N
|  N N N N
|
键长(nm)
| 0.154
| 0.134
| 0.120
| 0.143
| 0.122
| 0.092
| 0.120
| 0.110
|
键能(kJ/mol)
| a
| b
|
| 358
| c=805
| 569
| d
|
|
氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
26、不能通过电解纯净的液态HF获得F2,其原因是_________;但电解液态KHF2时,两极分别得到F2和H2,则F2在电解池的_____极产生。
27、利用化学反应也能制取氟。请配平下列化学方程式:
____K2MnF6+____SbF5→____KSbF6+____MnF3+____F2↑
28、一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随pH的分布曲线如图示。
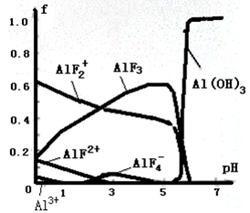
用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式:____________________。
参考答案:23、第二周期第ⅥA族 24、 ;4HF+SiO2→SiF4+2H2O 25、a<b<c<d;键越长
;4HF+SiO2→SiF4+2H2O 25、a<b<c<d;键越长
26、氟化氢是共价化合物,纯液态时不电离,因而不导电 (1分);阳(1分)
27、2 4 4 2 1(2分)
28、AlF2++3OH-→Al(OH)3↓+2F-(2分),AlF3+3OH-→Al(OH)3↓+3F-(2分)
本题解析:A、B、C、D、E五种短周期元素, C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物,这说明A是氧元素,C是氢元素,D是钠元素。C、A、B、D、E的核电荷数依次增大,因此B是F元素;CB可与EA2反应生成C2A和气体物质EB4,EB4蒸气的密度是相同条件下空气密度的3.586倍,则其相对分子质量是29×3.586=104,所以E的相对原子质量是104-19×4=28,因此E是硅元素。则
23、氧元素的原子序数是8,位于元素周期表的第二周期第ⅥA族。
24、根据以上分析可知D2A2是过氧化钠,属于离子化合物,电子式为 ;HF与二氧化硅反应的化学方程式4HF+SiO2→SiF4+2H2O ;
;HF与二氧化硅反应的化学方程式4HF+SiO2→SiF4+2H2O ;
25、根据表中数据可知碳碳单键的键能小于碳碳双键的键能,则a<b;键长越短,键能越大,所以a<b<c<d;
26、氟化氢是共价化合物,液态时不电离,因此不能导电;电解液态KHF2时,两极分别得到F2和H2,其中F元素的化合价由-1价升高到0价失去电子,被氧化,所以F2在电解池的阳极产生。
27、根据反应式可知Mn元素的化合价从+4价降低到+3价,得到1个电子;F元素的化合价从-1价升高到0价,失去1个电子,则根据电子得失守恒可知配平后的方程式为2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑;
28、根据图像可知用NaOH使混合液的pH从5调整到7时AlF3的浓度降低,而氢氧化铝增大,这说明AlF3转化为氢氧化铝,因此反应的离子方程式为AlF3+3OH-→Al(OH)3↓+3F-。
考点:考查元素及物质推断、元素周期律的应用、氧化还原反应方程式配平、铝及其化合物的转化等
本题难度:困难
3、计算题 (6分)已知一定质量的硫与100mL某浓度的KOH溶液恰好完全反应,其反应方程式为:3S+6KOH(浓)= 2K2S+K2SO3+3H2O,若被还原的硫元素为1.6g。求该KOH溶液的物质的量的浓度。
参考答案:3S+6KOH(浓)=2K2S+K2SO3+3H2O 被还原的硫元素质量
6mol 2mol×32g/mol ?c(KOH)="0.15mol/0.10L=1.5mol/L" (3分)
n(KOH) 1.6g?答:该KOH溶液的物质的量的浓度是1.5mol/L
n(KOH)="6mol×1.6g/(2mol×32g/mol)=0.15mol" (3分
本题解析:略
本题难度:简单
4、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
 SiO2 +
SiO2 + C+
C+ N2
N2
 Si3N4+
Si3N4+ CO
CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是___________,其还原产物是___________;
(3)该反应的平衡常数表达式为K=___________;
(4)若知上述反应升高温度,其平衡常数值减小,则该反应的反应热ΔH______零(填“大于”、“小于”或“等于”);
参考答案:(1) (2)N2;Si3N4
(2)N2;Si3N4
(3)c6(CO)/c2(N2)
(4)小于
本题解析:
本题难度:一般
5、选择题 有一未完成的离子方程式____+XO3-+6H+=3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为
A.1∶1
B.3∶1
C.5∶1
D.7∶1
参考答案:C
本题解析:根据原子守恒和电荷守恒确定空缺的物质为5X-,反应中5X-化合价升高被氧化生成氧化产物5/2X2,XO3-被还原成成还原产物1/2X2,故答案为C。
本题难度:一般