1、填空题 氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识回答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为 ,反应中消耗1mol的MnO4—时转移电子数为 。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 & www.91eXam.org#160; ,又变为棕黄色的原因是 。
2、填空题 (本题16分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:
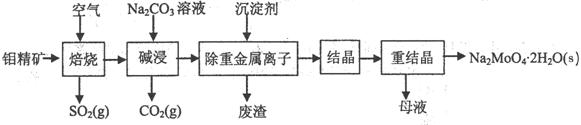 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
②____________________________
(2)写出焙烧时生成MoO3的化学方程式为:______________________________________
(3)写出“碱浸”反应的离子方程式:
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是 。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
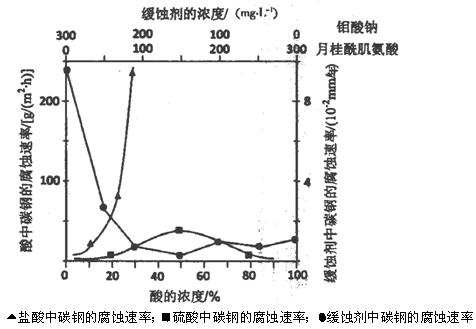
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 ________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是 _________________________________________。
③若缓释剂钼酸钠—月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2 Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
3、简答题 硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目的是_______,滤液1后两步操作的目是:______.
(2)完成加漂粉精反应的离子方程式:
______Fe(OH)2+____________+____________→______Fe(OH)3+______Cl-
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是______.
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
______,______(用文字叙述)
(5)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥.
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于______.
4、实验题 硫酸钠-过氧化氢-氯化钠加合物(xNaSO4·yH2O2·zNaCl)又称固体双氧水,是一种新型精细化工产品,具有漂白、杀菌、消毒等作用。为探究该加合物的组成,某化学兴趣小组设计并进行了如下实验:
第一步:准确称取6.945g样品,配制成250.00ml无色溶液A
第二步:准确量取25.00ml溶液A于锥形瓶中,加适量稀硫酸酸化后,用0.0400mol/LKMnO4标准溶液滴定至终点,消耗溶液KMnO420.00ml
第三步:另取25.00ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.932g.
请回答下列问题:
(1)欲配制无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有?。
(2)配平下列离子方程式______MnO4-+_____H2O2+_________=______Mn2++_____O2↑+______。
(3)滴定前,KMnO4标准溶液应盛装于中?(填仪器名称),滴定终点现象为?。
(4)第三步能否通过加入AgNO3溶液的方法来测定?为什么
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则Y值______________(填“偏
高 偏低 无影响”)
(6)通过计算确定样品的组成为?。
5、选择题 向含有Fe2+、I-、Br-的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。
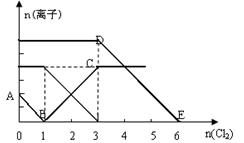
下列说法正确的是
A.B点时溶液中含有I-和Br-
B.DE段表示n (F e2+)的变化情况
e2+)的变化情况
C.原溶液中n (Fe2+) :n (I-) :n (Br-) =" 3" :1 :2
D.当通入2mol Cl2时,溶液中发生的离子反应是:2Fe2+ + 2I- + 2Cl2 = 2Fe3+ + I2 + 4 Cl-