|
高中化学知识点总结《铁的氧化物》在线测试(2019年最新版)(二)
2019-06-28 21:28:41
【 大 中 小】
|
1、实验题 (10分)实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参与反应)。请回答下列问题:
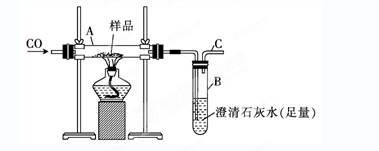
(1)该实验中炼铁的方法是________(填字母)。
A.热分解法
B.热还原法
C.电解法
D.湿法冶金
| (2)实验开始后,B中的现象是____________________,A中反应的化学方程式是________________________________________________________。
(3)写出铝和Fe2O3?反应的化学方程式?演示实验引发该反应的方法是?
(4)若样品的质量为3.6 g,通入足量的CO充分反应后,B增重2.64 g,则样品中铁的质量分数为_____?_? (结果保留一位小数)。
参考答案:(1)B? (2)有白色沉淀生成;Fe2O3+3CO2Fe+3CO2
(3) Fe2O3+2Al2Fe+Al2O3?在铝热剂上放KClO3,插上镁条并将镁条点燃?
(4)62.2%
本题解析:(1)CO具有还原性,答案选B。
(2)CO的氧化产物是CO2,CO2能和氢氧化钙溶液反应生成白色沉淀。CO还原氧化铁的方程式为Fe2O3+3CO2Fe+3CO2。
(3)铝也具有还原性,能发生铝热反应,方程式为 Fe2O3+2Al2Fe+Al2O3。
(4)B增重2.64 g,说明CO2是2.64g,物质的量是0.06mol。因此根据方程式可知生成铁是0.04mol,所以样品中铁的质量分数为0.04mol×56g/mol÷3.6g×100%=62.2%。
本题难度:一般
2、计算题 (13分)将8.6 g的铜银合金完全溶于浓HNO3,若反应中硝酸的还原产物只有NO2和N2O4,且它们的体积均为1.12 L(标准状况),则该铜银合金中铜和银的质量分别为多少?
参考答案:3.2 g? 5.4 g
本题解析: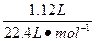 ="0.05" mol ="0.05" mol
设合金中Cu为x mol,Ag为y mol。则
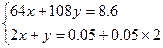 解得 解得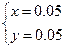
所以m(Cu)="64" g·mol-1×0.05 mol="3.2" g
m(Ag)="8.6" g-3.2 g="5.4" g
本题难度:简单
3、推断题 以下一些氧化物和单质之间可发生如图所示的反应: 其中,氧化物( I)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ) 在反应条件下都是气体。

(1)氧化物(I)的化学式(分子式)是____, 氧化物(Ⅱ)的化学式(分子式)是____。
(2)反应①的化学方程式是___, 反应②的化学方程式是_____, 反应③的化学方程式是____。
参考答案:(1) Fe2O3 ;CO
(2) Fe2O3+3CO 2Fe +3CO2 ;CO +H2O 2Fe +3CO2 ;CO +H2O CO2+H2 ;H2O+C CO2+H2 ;H2O+C H2+CO H2+CO
本题解析:
本题难度:一般
4、填空题 (14分)(1)现有浓度各为1 mol/L的FeCl3、FeCl2、CuCl2的混合溶液100mL,加入一定量的铁粉,按下列情况填空:
①充分反应后铁粉有剩余,则溶液中一定含有__________阳离子,一定没有__________阳离子。(2分)有关反应的离子方程式是__________________________
__________________________________________________________。(2分)
②充分反应后铁粉无剩余,有铜生成。则反应后的溶液中一定含有_________阳离子;溶液中可能含有_________阳离子,该阳离子在溶液中物质的量的可能存在范围是:? ______________________。(4分)
③充分反应后,无固体沉淀物存在,反应后的溶液中一定含有____和____阳离子。(2分)
(2)现有AlCl3和FeCl3的混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol。在此溶液中加入90 mL 4 mol / L的NaOH溶液,使其充分反应;设Al3+ 的物质的量与总物质的量的比值为x。
①根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是___________;物质的量是__________mol。(2分)
②计算沉淀中只有Fe(OH)3时的x的取值范围:_____________________。(2分)
参考答案:(1)①Fe2+? ;?Fe3+、Cu2+?(2分)
2Fe3+ +Fe ="3Fe2+?" Cu2+ + Fe ="Fe2+" +Cu(2分)
② Fe2+?;Cu2+? 0≤n(Cu2+)<0.1mol?(4分)
③ Fe2+?、Cu2+?(2分)
(2)①沉淀全是Fe(OH)3为0.06mol(2分)
②0≤X≤0.6 (2分)
本题解析:略
本题难度:简单
5、填空题 (12分)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN?溶液,溶液呈红色。将上述溶液均分置于甲、乙两支试管中,向甲试管中加入4滴饱和FeCl3溶液,向乙试管中加入4滴浓KSCN溶液,充分振荡,观察溶液颜色变化。然后再分别向上述两支试管中滴加5滴0.5 mol/L NaOH溶液,观察现象并回答下列问题。
⑴向两支试管中分别加入饱和FeCl3溶液和浓KSCN溶液后,均可观察到的现象是__________________________________。
⑵产生上述现象后,向两支试管中滴加NaOH溶液,均可观察到的现象是_________
______________,产生该现象的原因是___________________________________。
⑶滴加NaOH溶液后,除观察到⑵中所述现象外,还会看到一支试管中有沉淀生成,另一支试管中几乎没有。有沉淀生成的试管是_________(填“甲”或“乙”)。
参考答案:

本题解析:略
本题难度:一般
|