1、选择题 Cu和Cu2O的混合物7.6 g与足量稀硝酸反应,产生NO气体在标准状况下体积为1.12 L,向所得溶液中加入足量的NaOH溶液,产生的沉淀经过滤、洗涤、干燥、灼烧后,得到黑色固体的质量是
A.8.8 g
B.9.2g
C.8 g
D.16 g
参考答案:A
本题解析:标准状况下体积为1.12 LNO气体的物质的量为0.05mol;反应过程中转移电子的物质的量为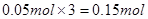 ;设铜的物质的量为x,氧化亚铜的物质的量为y;所以得
;设铜的物质的量为x,氧化亚铜的物质的量为y;所以得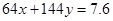 ;
;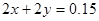 ;解得
;解得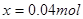 ;
;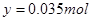 ;由铜元素守恒得最后得到的黑色固体为氧化铜且物质的量为
;由铜元素守恒得最后得到的黑色固体为氧化铜且物质的量为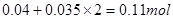 ,所以其质量为8.8 g;
,所以其质量为8.8 g;
本题难度:简单
2、计算题 已知:CuS、Cu2S是两种黑色不溶于水的固体,但一定条件下都能与稀HNO3反应,用离子方程式表示为:
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如下表所示:
实验序号
| a
| b
| c
|
样品质量(g)
| 9.6
| 12.8
| 64.0
|
气体体积(L)
| 5.04
| 6.72
| V
|
?
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
(1)a组实验结束后,溶液中c(NO3-)=?;
(2)b组实验结束后,溶液的pH=?;
(3)通过计算分析实验c组中产生气体的体积(V)范围?。
参考答案:(1)2.75mol/L
(2) 0
(3)7L< V <11.2L
本题解析:(1)设9.6g的样品中CuS的物质的量为x,Cu2S的物质的量为y
96x+160y=9.6? 8x/3+10y/3=0.225
解得:x=y=0.0375mol, c(NO3-)= (0.5mol-0.225 mol)/0.4L=2.75mol/L
(亦可根据N原子守恒来求)
(2)设12.8g的样品中CuS的物质的量为x,Cu2S的物质的量为y
96x+160y=12.8
8x/3+10y/3=0.3
解得:x=y=0.05mol
根据方程式①、②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol
故剩余n(H+)=0.1mol,c(H+)=1mol/L? pH=0
(3)首先判断64g样品中CuS、Cu2S的物质的量皆为0.25mol,分别跟0.5mol硝酸反应时均过量。因此采用极端假设法思考:
若HNO3均与CuS反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=11.2L
若HNO3均与Cu2S反应:硝酸不足,则V(NO)=0.5mol×10/16×22.4L/mol=7L
所以:c中产生气体体积(V)等于7L< V <11.2L。
本题难度:简单
3、选择题 波尔多液是一种常用的植物杀菌剂,它用硫酸铜、生石灰、水按一定的比例配制而成,是一种天蓝色黏稠状悬浮液体。通常现用现配,你认为下列哪种容器不能用来盛装波尔多液( )。
A.塑料容器
B.铜制容器
C.铁制容器
D.陶器
参考答案:C
本题解析:铁的金属性比铜强,容易置换出铜:Cu2++Fe=Fe2++Cu。
本题难度:简单
4、选择题 把铜粉和铁粉的混合物,放入一定量的稀硝酸中,微热,反应完毕发现铜有剩余,则溶液中含有的阳离子是?
A.Cu2+、Fe2+
B.Cu2+、Fe2+、Fe3+
C.Cu2+、Fe3+
D.Fe3+
参考答案:A
本题解析:铜有剩余,说明硝酸已经反应完,可能发生的反应有:
Fe+4H++NO3-====Fe3++NO↑+2H2O
3Cu+8H++2NO3-====3Cu2++2NO↑+4H2O
Fe+2Fe3+====3Fe2+
Cu+2Fe3+====2Fe2++Cu2+
从反应可知,当铜有剩余,溶液中Fe3+已消耗尽,铜跟Fe2+不能反应,所以溶液中的阳离子有Cu2+、Fe2+,选A。
本题难度:一般
5、选择题 将下列各种单质投入或通入CuSO4溶液中,能产生铜单质的是
A.Fe
B.Na
C.H2
D.Ag
参考答案:A
本题解析:
根据金属活动性顺序表,铜之前的金属铁可以从铜的盐溶液中置换出铜,铜之后的银不可。只有金属能置换铜,氢气不能置换铜。钠虽然在铜之前,但是钠太活泼了,投入溶液中会与溶液中的水反应,置换出氢气,不能置换出铜。
本题难度:简单