1、填空题 (l4分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝 热反应,产物中有单质B生成;
②另取20 g A全部溶于0.2 L? 6.0 mol· 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,有气体放出,同时生成溶液D,还残留有固体物质B。请回答:
(1)①产物中的单质B是__________________。
(2)②中所发生的各反应的化学方程式是___________________________________。
(3)③中所发生的各反应的离子方程式是_________________________________。
(4)若溶液D的体积仍视为0.2L,则该溶液中c(Mg2+)为__________________,
c(Fe2+)为___________________。
2、填空题 (15分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
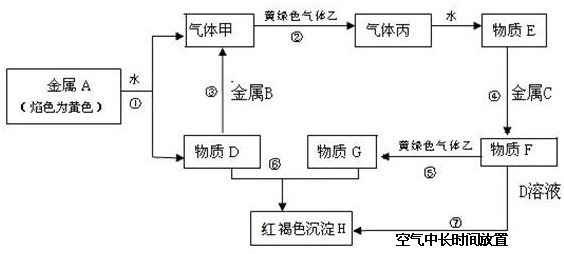
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A___________、F___________、H___________。
(2)说出黄绿色气体乙的一种用途___________。
(3)反应⑤的离子方程式为____________。
(4)反应过程⑦可能观察到的实验现象___________。
(5)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为_________________________。
3、实验题 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
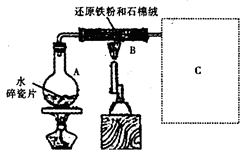
(1)装置B中发生反应的化学方程式是?。
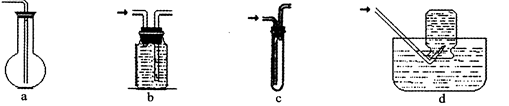
(2)虚线框图C的气体收集装置是下图中的??(选填字母编号)。
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:?
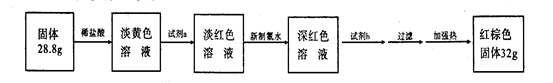
试剂a的化学式是?,试剂b的化学式是?;加入新制氯水后溶液红色加深的原因是(用离子方程式表示)?。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
?;为了对所提出的假设2进行验证,实验方案是?
??。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为?。
4、选择题 将2.72g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得反应后放出标准状况下气体0.224 L.则下列判断中正确的是
A.原混合物中n(Fe)∶n(Fe2O3)=3∶1
B.反应后溶液中Fe2+和Fe3+的物质的量之比为3∶1
C.实际参加反应HCl的物质的量为0.08mol
D.向溶液中滴入KSCN溶液,显红色
5、选择题 用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
A.FeO
B.Fe2O3
C.CaO
D.Cu2O