1、填空题 (15分)X、Y、Z、Q、W为按原子序数由小到大排列的五种短周期元素,已知:
①X元素与Q处于同一主族,其原子价电子排布式都为ns2np2,且X原子半径小于Q的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ·mol-1):
I1
| I2
| I3
| I4
| …
|
496
| 4562
| 6912
| 9540
| …
|
?
请回答:
(1)XY2分子空间构型为?,X原子的轨道杂化方式为?;QX的晶体结构与金刚石的相似,其中X原子的杂化方式为?,微粒间存在的作用力是?。
(2)晶体ZW的熔点比晶体XW4明显高的原因是?。
(3)氧化物MO的电子总数与QX的相等,则M为______________(填元素符号)。MO是优良的耐高温材料,其晶体结构与ZW晶体相似。MO的熔点比CaO的高,其原因是_________________________。

(4)ZW晶体的结构示意图如右图。已知:ρ(ZW)=2.2 g·cm-3,NA=6.02×1023mol-1,则ZW晶体中两个最近的Z离子中心间的距离为?。
参考答案:⑴?直线型分子;? sp杂化; sp3杂化;共价键 ; ⑵NaCl为离子晶体而CCl4为分子晶体;
⑶Mg? Mg2+半径比Ca2+小,MgO晶格能大?⑷? 4.0×10-8 cm
本题解析:根据题意可推知各种元素分别为:X是C;Y的O;Z是Na;Q是Si;W是Cl。(1)CO2分子空间构型为直线型;其中X原子的轨道杂化方式为sp杂化;SiC的晶体结构与金刚石的相似,是原子晶体,其中C原子的杂化方式为sp3杂化;C原子与Si原子之间的作用力是共价键。(2)NaCl晶体是离子晶体,离子间通过离子键结合,离子键是一种强烈的相互作用,断裂较难,因此该化合物的熔点高;而CCl4是由分子通过分子间作用力结合,分子间作用力是一种比较弱的作用,破坏比较容易,因此该晶体的熔沸点比较低,CCl4在室温下为液态。(3)SiC的电子数是20,而氧化物MO的电子总数与SiC的相等,则M的电子数是12,该元素是Mg;MgO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MgO的熔点比CaO的高,是因为Mg2+半径比Ca2+小,MgO晶格能大,断裂其离子键比CaO难,所以熔点较高。(4)在一个晶胞中含有的Na+:8×1/8+6×1/2=4;含有的Cl-:12×1/4+1=4.即一个晶胞中含有4个NaCl.所以晶胞的边长为L,则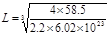 在晶胞中两个最近的Na+的距离是
在晶胞中两个最近的Na+的距离是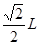 整理解得
整理解得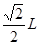 =4.0×10-8 cm。
=4.0×10-8 cm。
本题难度:一般
2、选择题 下列有关σ键的说法中错误的是
[? ]
A.如果电子云图像由两个s电子重叠形成的,即形成s-sσ键
B.s电子与p电子形成s-pσ键
C.p电子与p电子不能形成σ键
D.HCl分子里含有一个s-pσ键
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列说法不正确的是
[? ]
A.二氧化硫是形成酸雨的一种有毒的酸性氧化物?
B.浓盐酸可以用铝制容器盛装
C.浓硝酸保存需要用棕色瓶?
D.NaClO中既有离子键又有共价键
参考答案:B
本题解析:
本题难度:简单
4、填空题 (15分)氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为?形,阳离子中氮的杂化轨道类型为?。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。
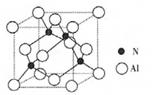
(3)X晶体中包含的化学键类型为______。(填字母标号)
A.离子键
B.共价键
C.配位键
D.金属键