1、填空题 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1 g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如下图所示。
请依图回答下列问题
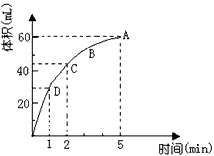
(1)实验时放出气体的总体积为_______________;
(2)放出一半气体所需要的时间为_______________;
(3)ABCD四点化学反应速率的由快到慢顺序为_____________________________;
(4)解释反应速率的大小变化原因________________________________;
(5)在5min后,收集到的气体体积不再增加,原因是________________________________。
参考答案:(1)60mL;
(2)1min;
(3)D>C>B>A;
(4)随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小
(5)此时双氧水已完全分解
本题解析:
本题难度:一般
2、选择题 关于反应速率、反应限度的下列说法错误的是( )
A.其它条件不变时,升高温度化学反应速率加快
B.其它条件不变时,增大浓度化学反应速率加快
C.化学反应达到反应限度时,正反应速率和逆反应速率相等
D.化学反应达到反应限度时,反应物的浓度和生成物的浓度相同
参考答案:A.升高温度,活化分子百分数增大,反应速率增大,故A正确;
B.增大反应物浓度,单位体积的活化分子数目增大,反应速率增大,故B正确;
C.当正逆反应速率相等时,达到平衡状态,故C正确;
D.达到平衡状态时,各物质的浓度不变,但不一定相等,故D错误.
故选D.
本题解析:
本题难度:简单
3、填空题 (5分)在密闭容器中,通入xmolH2和ymolI2(g),改变下列条件,反应速率将如何改变?(填“增大”、“减小”或“不变”)
(1)升高温度 ;
(2)加入催化剂 ;
(3)容器容积充入H2 ;
(4)扩大容器的体积
(5)容器容积不变,通入氖气
参考答案:(1)增大(2)增大或减小(3)增大(4)减小(5)不变(各1分)
本题解析:考查外界条件对反应速率的影响。
(1)升高温度,反应速率移动加快。
(2)催化剂可以改变反应速率,因此可能增大也可能减小。
(3)充入氢气,则增大反应物浓度,反应速率加快。
(4)扩大容器容积,则压强降低,反应速率减小。
(5)容器容积不变,充入氖气,由于反应物的浓度不变,所以反应速率是不变的。
本题难度:一般
4、选择题 在化工生产中,如果再加快反应速率,应该优先考虑的科研方向是
[? ]
A.提高设备强度,以便加压
B.选择适宜的催化剂
C.采用高温
D.用块状反应物代替粉末状反应物
参考答案:B
本题解析:
本题难度:一般
5、选择题 A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g) cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:

下列说法正确的是
A.0~t1时间段内,平均反应速率v(B)=O.04/t1 mol·(L·min)-1
B.若起始时n(D)=0,则t2时v(D)=0.20/t2 mol·(L·min)-1
C.升高温度,v(B)、vC)、v(D)均增大
D.b:d=6:1
参考答案:C
本题解析:A. B的起始量不可知,无法求出0~t1min内的平均速率。B. v(D)=0.20/t2 mol·(L·min)-1为0~t1时间段内平均速率而非t1时刻的瞬时速率。故B错。C.升高温度,化学反应速率增大,正确。D.由表中数据可得:t1到t2时间段内
aA(s)+bB(g) cC(g)+dD(g)
cC(g)+dD(g)
△n /mol 0.06 0.06 0.1
所以:b:c:d=3:3:5 故D错误。
考点:了解化学反应速率的概念、反应速率的定量表示方法;理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,认识其一般规律。
本题难度:一般