1、填空题 某温度下,一定量的混合气体在密闭容器中发生如下反应:mA(气)+nB(气)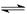 pC(气)达平衡后,将气体体积缩小到原来的
pC(气)达平衡后,将气体体积缩小到原来的 ,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是:?。
,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是:?。
参考答案:m+n<p。
本题解析:
【错解分析】m+n>p
【正解】温度一定,气体的体积缩小到原来的二分之一,所有物质的浓度都发生相应的变化,相当于给体系加压,应从压强条件改变,引起平衡移动进行讨论。但讨论某物质的浓度变化时,不仅要从平衡移动方面(化学变化)考虑。还要从压强引起体积变化,进而引起浓度变化(物理因素)方面考虑。若从单方面分析,必然得出错误的结论。如:仅从加压引起平衡移动考虑,C的浓度为原来的1.9倍,一定是平衡向正反应方向移动的结果,反应物气体的总物质的量大于生成物气体的总物质的量,即m+n=p。
本题考虑到体积缩小到原来的二分之一这一瞬间,所有物质的浓度将增大到原来的二倍,C的浓度也应为原来的二倍。题目给的有关达到新平衡时C的浓度为原来的1.9倍,意味着平衡是向逆反应方向移动。因此,结论为:m+n<p。
本题难度:简单
2、选择题 在一定条件下,对于密闭容器中进行的反应:
A(g)+B(g) C(g)+D(g)
C(g)+D(g)
下列情况可以说明这一反应已经达到平衡状态的是(?)
A.A、B、C、D的浓度相等? B.A、B、C、D在密闭容器中共存
C.A、B、C、D的浓度不再变化? D.A消耗的速率与C消耗的速率相等
参考答案:C
本题解析:化学平衡的本质特征就是正、逆反应速率相等,表现就是各物质的浓度不再变化。
本题难度:一般
3、填空题 (6分)在密闭容器中进行如下反应:mA(g)+nB(g)  pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
(1)写出上述化学方程式中各物质的计量数:m=________,n=________,p=________
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示。由此可知,该反应为 ?(填“吸热”或“放热”)反应。

(3)该反应的平衡常数表示式为 ,升高温度,K值将 (填“增大”、“减小”或“不变”)。
参考答案:(6分):(1)3 1 2(每空1分) (2)放热(1分)
(3)K=c2(C)/c3(A).c(B)?(2分)减小(2分)
本题解析:(1)平均反应速率v(C)=2v(B),所以B的浓度减少了1/3amol/L。根据变化量之比是相应的化学计量数之比可知,m︰n︰p=3︰1︰2,所以m=3,n=1,p=2。
(2)根据图像可知,T1首先达到平衡状态,所以温度是T1大于T2。温度高,C的百分含量低,说明升高温度平衡向逆反应方向进行,所以正反应是放热反应。
(3)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以平衡常数的表达式是K=c2(C)/c3(A).c(B);升高温度平衡向逆反应方向进行,,所以平衡常数是减小的。
本题难度:一般
4、填空题 (10分)温室效应和资源短缺 等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)?
等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)?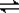 ?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
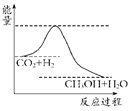
(1)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0
B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0
D.ΔH<0,ΔS>0
(2)该反应平衡常数K的表达式为________________________________。
(3)温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
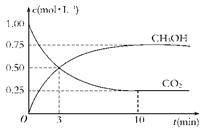
(4)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 mol CO2和3 mol ?H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)________mol·L-1·min-1。
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有________。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
E.充入He(g),使体系总压强增大
参考答案:(1)C (2) (3)增大? (4)0.225 (5)CD
本题解析:略
本题难度:一般
5、选择题 在某一容积为2L的密闭容器内,加入0.2mol的CO和 0.2mol的 H2O(g),在催化剂存在的条件下恒温下发生如下反应:CO(g)+H2O(g)? CO2(g)+H2(g);ΔH=a kJ/mol(a>0)。反应达到平衡后,测得c(CO)∶c(CO2)=3∶2。下列说法正确的是(?)
A.当体系压强不变时反应一定达到平衡
B.反应放出的热量为 0.2a kJ
C.若升高温度,v(正)加快, v(逆)减慢,平衡正向移动
D.在相同条件下再加入0.2mol的CO和0.2mol的 H2O(g),重新达平衡时,c(CO)∶c(CO2)=3∶2
参考答案:D
本题解析:略
本题难度:简单